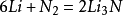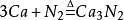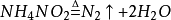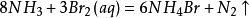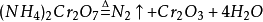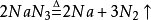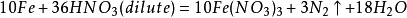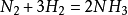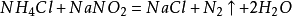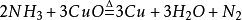發現簡史,理化性質,物理性質,化學性質,相關反應,氮化物反應,活潑金屬反應,非金屬反應,大氣固氮,氮氣用途,化工合成,其他用途,化學鍵,鍵特性,鍵型,共價鍵,配位鍵,製備方法,制氮工藝,實驗室製法,深冷空分制氮,變壓吸附制氮,膜分離制氮,氮氣純化方法,注意事項,危險性,急救措施,消防措施,泄漏應急處理,操作處置儲存,接觸控制,相關數據,反應活性,毒理學資料,生態學資料,廢棄處置,運輸信息,法規信息,氮的氧化物,
發現簡史
氮氣在大氣中含量雖多於氧氣,但是由於它的性質不活潑,所以人們是在認識氧氣之後才認識氮氣的。不過它的發現卻早於氧氣。1755年英國化學家布拉克(Black,J.1728-1799)發現碳酸氣之後不久,發現木炭在玻璃罩內燃燒後所生成的碳酸氣,即使用
苛性鉀溶液吸收後仍然有較大量的空氣剩下來。後來他的學生D·盧瑟福繼續用動物做實驗,把老鼠放進封閉的玻璃罩里直至其死後,發現玻璃罩中空氣體積減少1/10;若將剩餘的氣體再用苛性鉀溶液吸收,則會繼續減少1/11的體積。D·盧瑟福發現老鼠不能生存的空氣里燃燒蠟燭,仍然可以見到微弱的燭光;待蠟燭熄滅後,往其中放入少量的磷,磷仍能燃燒一會,對除掉空氣中的助燃氣來說,效果是好的。把磷燃燒後剩餘的氣體進行研究,D·盧瑟福發現這氣體不能維持生命,具有滅火性質,也不溶於苛性鉀溶液,因此命名為“濁氣”或“毒氣”。
在同一年,普利斯特里作類似的燃燒實驗,發現使1/5的空氣變為碳酸氣,用石灰水吸收後的氣體不助燃也不助呼吸。由於他同D·盧瑟福都是深信燃素學說的,因此他們把剩下來的氣體叫做“被燃素飽和了的空氣”。
理化性質
物理性質
氮氣在常況下是一種無色無味的氣體,熔點是63 K,沸點是77 K,臨界溫度是126 K,難於液化。溶解度很小,常壓下在283 K 時一體積水可溶解0.02體積的氮氣。
氮氣是難液化的氣體。氮氣在極低溫下會液化成無色液體,進一步降低溫度時,更會形成白色晶狀固體。在生產中,通常採用黑色鋼瓶盛放氮氣。其他物理性質見下表:
項 目
化學式
相對分子質量
CAS登錄號
EINECS登錄號
英文名稱
熔點
沸點,101.325kPa(1atm)時
臨界溫度
臨界壓力
臨界體積
臨界密度
臨界壓縮係數
液體密度,-180℃時
液體熱膨脹係數,-180℃時
表面張力,-210℃時
氣體密度,101.325 kPa(atm)和70F(21.1℃)時
氣體相對密度,101.325 kPa(1atm)和70F時(空氣=1)
汽化熱,沸點下
熔化熱,熔點下
氣體定壓比熱容cp,25℃時
氣體定容比熱容cv,25℃時
氣體比熱容比,cp/cv
液體比熱容,-183℃時
固體比熱容,-223℃時
溶解度參數
液體摩爾體積
在水中的溶解度,25℃時
氣體黏度,25℃時
液體黏度,-150℃時
氣體熱導率,25℃ 時
液體熱導率,-150℃時 | 屬 性
N2
28.013
7727-37-9
231-783-9
Nitrogen
63.15K,-210℃
77.35K,-195.8℃
126.1K,-147.05℃
3.4MPa,33.94bar,33.5atm,492.26psia
90.1cm3/mol
0.3109g/cm3
0.292
0.729g/cm3
0.00753 1/℃
12.2×10-3 N/m,12.2dyn/cm
1.160kg/m3,0.0724 lb/ft3
0.967
202.76kJ/kg,87.19 BTU/1b
25.7kJ/kg,11.05 BTU/1b
1.038kJ/(kg· k),0.248 BTU/(1b·R)
0.741kJ/(kg· k),0.177 BTU/(1b·R)
1.401
2.13kJ/(kg·k),0.509 BTU/(1b·R)
1.489kJ/(kg·k),0.356 BTU/(1b·R)
9.082(J/cm3)0.5
34.677cm3/mol
17.28×10-6(w)
175.44×10-7Pa·s,17.544μPa·s
0.038mPa ·s,0.038 cp
0.02475W/(m · K)
0.0646W/(m · K) |
化學性質
由
氮元素的氧化態-
吉布斯自由能圖也可以看出,除了NH
4+離子外,氧化數為0的N
2分子在圖中曲線的最低點,這表明相對於其它氧化數的氮的化合物來講的話,N
2是熱力學穩定狀態結構。氧化數為0到+5之間的各種氮的化合物的值都位於HNO
3和N
2兩點的連線(圖中的虛線)的上方。因此,這些化合物在
熱力學上是不穩定的,容易發生
歧化反應。在圖中的一個比N
2分子值低的是NH
4+離子。
正價氮呈酸性,負價氮呈鹼性。
由氮分子中三鍵鍵能很大,不容易被破壞,因此其化學性質十分穩定,只有在高溫高壓並有催化劑存在的條件下,
氮氣成分可以和氫氣反應生成氨。同時,由於氮分子的化學結構比較穩定,氰根離子CN
-和碳化鈣CaC
2中的C
22-和氮分子結構相似。
氮分子中存在氮氮叄鍵,鍵能很大(941 KJ/mol),以至於加熱到3273K時僅有0.1%離解,氮分子是已知雙原子分子中最穩定的。氮氣是CO的等電子體,在結構和性質上有許多相似之處。
不同活性的金屬與氮氣的反應情況不同。與鹼金屬在常溫下直接化合;與鹼土金屬 —般需要在髙溫下化合;與其他族元素的單質反應則需要更高的反應條件。
相關反應
氮化物反應
活潑金屬反應
N
2與
鹼土金屬Mg 、Ca 、Sr 、Ba 在加熱的溫度下反應,如:
非金屬反應
N2與矽和其它族元素的單質一般要在高於1200℃的溫度下才能反應。
大氣固氮
N2+O2——→2NO ;2NO+O2——→2NO2 ;3NO2+H2O——→2HNO3+NO
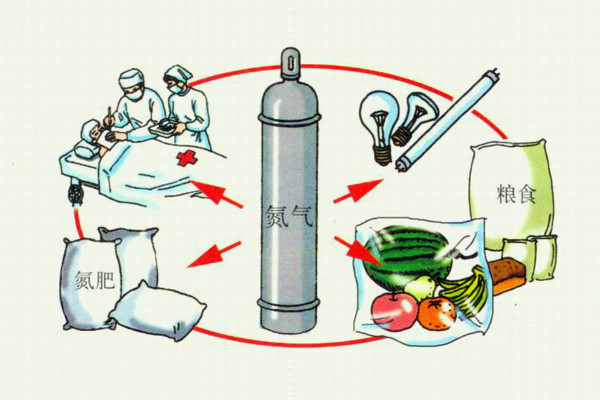 氮氣的用途
氮氣的用途氮氣用途
化工合成
人類能夠有效利用氮氣的主要途徑是合成氨,但要求條件很高。近年來,人們在竭力弄清植物固氮的機理,爭取用化學的方法模擬生物固氮,來實現當溫和條件下開發利用空氣中的氮資源。氮主要用於
合成氨,反應式為
( 條件為高壓,高溫、和催化劑。反應為
可逆反應)還是合成纖維(
錦綸、腈綸),合成樹脂,合成橡膠等的重要原料。 氮是一種營養元素還可以用來製作化肥。例如:
碳酸氫銨NH
4HCO
3,
氯化銨NH
4Cl,
硝酸銨NH
4NO
3等等。
其他用途
由於氮的化學惰性,常用作
保護氣體,如:瓜果,食品,燈泡填充氣。以防止某些物體暴露於空氣時被氧所氧化,用氮氣填充糧倉,可使糧食不霉爛、不發芽,長期保存。液氮還可用作深度冷凍劑。作為
冷凍劑在醫院做除斑,包,豆等的手術時常常也使用,即將斑,包,豆等凍掉,但是容易出現疤痕,並不建議使用。高純氮氣用作色譜儀等儀器的載氣。用作銅管的光亮退火保護氣體。跟高純
氦氣、高純二氧化碳一起用作雷射切割機的雷射氣體。氮氣也作為食品保鮮保護氣體的用途。在化工行業,氮氣主要用作保護氣體、置換氣體、洗滌氣體、安全保障氣體。用作鋁製品、鋁型材加工,鋁薄軋制等保護氣體。用作回流焊和波峰焊配套的保護氣體,提高焊接質量。用作浮法玻璃生產過程中的保護氣體,防錫槽氧化。
化學鍵
由於單質
N2在常況下異常穩定,人們常誤認為氮是一種化學性質不活潑的元素。實際上相反,元素氮有很高的化學活性。N的電負性(3.04)僅次於F、O、Cl和Br,說明它能和其它元素形成較強的鍵。另外單質N
2分子的穩定性恰好說明N原子的活潑性。問題是人們還沒有找到在常溫常壓下能使N
2分子活化的有利條件。但在自然界中,植物根瘤上的一些細菌卻能夠在常溫常壓的低能量條件下,把空氣中的N
2轉化為氮化合物,作為肥料供作物生長使用。所以
固氮的研究一直是一個重要的科學研究課題。因此我們有必要詳細了解氮的成鍵特性和價鍵結構。
鍵特性
氮氣分子中對成鍵有貢獻的是三對電子,即形成兩個π鍵和一個σ鍵。 對成鍵有貢獻,成鍵與反鍵能量近似抵消,它們相當於孤電子對。由於N
2分子中存在叄鍵N≡N,所以N
2分子具有很大的穩定性,將它分解為原子需要吸收941.69kJ/mol的能量。N
2分子是已知的
雙原子分子中最穩定的,氮氣的
相對分子質量是28。氮氣通常不易燃燒且不支持燃燒。
化學式為N
2。
鍵型
N原子的
價電子層結構為2s2p3,即有3個成單電子和一對
孤電子對,以此為基礎,在形成化合物時,可生成如下三種鍵型:
1.形成離子鍵
3.形成配位鍵
N原子有較高的
電負性(3.04),它同電負性較低的金屬,如Li(電負性0.98)、Ca(電負性1.00)、Mg(電負性1.31)等形成二元
氮化物時,能夠獲得3個電子而形成N
3-離子。
N
3-離子的負電荷較高,半徑較大(171pm),遇到水分子會強烈水解,因此的離子型化合物只能存在於乾態,不會有N
3-的
水合離子。
共價鍵
N原子同
電負性較高的非金屬形成化合物時,形成如下幾種共價鍵:
⑴N原子採取sp3雜化態,形成三個
共價鍵,保留一對孤電子對,分子構型為三角錐型,例如NH
3,NF
3,NCl
3等。若形成四個共價單鍵,則分子構型為正四面體型,例如銨根離子。
⑵N原子採取sp2雜化態,形成2個
共價鍵和一個鍵,並保留有一對
孤電子對,分子構型為角形,例如Cl—N=O 。(N原子與Cl 原子形成一個σ 鍵和一個
π鍵,N原子上的一對孤電子對使分子成為角形。) 若沒有孤電子對時,則分子構型為三角形,例如硝酸分子或硝酸根離子。硝酸分子中N原子分別與三個O原子形成三個
σ鍵,它的π軌道上的一對電子和兩個O原子的成單
π電子形成一個三中心四電子的不定域π鍵。在硝酸根離子中,三個O原子和中心N原子之間形成一個四中心六電子的不定域
大π鍵。
這種結構使硝酸中N原子的表觀
氧化數為+5,由於存在大π鍵,硝酸鹽在常況下是足夠穩定的。
⑶N原子形成一個
共價叄鍵,並保留有一對
孤電子對,分子構型為直線形,例如N
2分子和CN
-中N原子的結構。(N原子不形成雜化軌道)
配位鍵
N原子在形成單質或化合物時,常保留有孤電子對,因此這樣的單質或化合物便可作為電子對給予體,向金屬離子配位。例如[Cu(NH3)4]2+或[Tu(NH2)5]7+等。
製備方法
制氮工藝
現場制氮是指氮氣用戶自購制氮設備制氮,工業規模製氮有三類:即深冷空分制氮、變壓吸附制氮和
膜分離制氮。利用各空氣的沸點不同使用液態空氣分離法,將氧氣和氮氣分離。將裝氮氣的瓶子漆成黑色,裝氧氣的漆成藍色。
實驗室製法
製備少量氮氣的基本原理是用適當的
氧化劑將氨或銨鹽氧化,最常用的是如下幾種方法:(以下dilute代表極稀)
(6)加熱
疊氮化鈉,使其受熱分解,可得到很純的氮氣:
深冷空分制氮
它是一種傳統的空分技術,已有九十餘年的歷史,它的特點是產氣量大,產品氮純度高,無須再純化便可直接套用於磁性材料,但它工藝流程複雜,占地面積大,基建費用高,需專門的維修力量,操作人員較多,產氣慢(18~24h),它適宜於大規模工業制氮,氮氣成本在0.7元/m3左右。
變壓吸附制氮
變壓吸附(Pressure Swing Adsorption,簡稱PSA)氣體分離技術是非低溫氣體分離技術的重要分支,是人們長期來努力尋找比深冷法更簡單的空分方法的結果。七十年代西德埃森礦業公司成功開發了
碳分子篩,為PSA空分制氮工業化鋪平了道路。三十年來該技術發展很快,技術日趨成熟,在中小型制氮領域已成為深冷空分的強有力的競爭對手。
變壓吸附制氮是以空氣為原料,用碳分子篩作吸附劑,利用碳分子篩對空氣中的氧和氮選擇吸附的特性,運用變壓吸附原理(加壓吸附,減壓解吸並使分子篩再生)而在常溫使氧和氮分離製取氮氣。
變壓吸附制氮與深冷空分制氮相比,具有顯著的特點:吸附分離是在常溫下進行,工藝簡單,設備緊湊,占地面積小,開停方便,啟動迅速,產氣快(一般在30min左右),能耗小,運行成本低,自動化程度高,操作維護方便,撬裝方便,無須專門基礎,產品氮純度可在一定範圍內調節,產氮量≤2000Nm3/h。但到2017年為止,除美國空氣用品公司用PSA制氮技術,無須後級純化能工業化生產純度≥99.999%的高純氮外(進口價格很高),國內外同行一般用PSA制氮技術只能製取氮氣純度為99.9%的普氮(即O2≤0.1%),個別企業可製取99.99%的純氮(O2≤0.01%),純度更高從PSA制氮技術上是可能的,但製作成本太高,用戶也很難接受,所以用非低溫制氮技術製取高純氮還必須加後級純化裝置。
膜分離制氮
膜分離空分制氮也是非低溫制氮技術的新的分支,是80年代國外迅速發展起來的一種新的制氮方法,在國內推廣套用還是2010-2017年的事。
膜分離制氮是以空氣為原料,在一定的壓力下,利用氧和氮在中空纖維膜中的不同滲透速率來使氧、氮分離製取氮氣。它與上述兩種制氮方法相比,具有設備結構更簡單、體積更小、無切換閥門、操作維護也更為簡便、產氣更快(3min以內)、增容更方便等特點,但中空纖維膜對
壓縮空氣清潔度要求更嚴,膜易老化而失效,難以修復,需要換新膜,
膜分離制氮比較適合氮氣純度要求在≤98%左右的中小型用戶,此時具有較好功能價格比;當要求氮氣純度高於98%時,它與同規格的
變壓吸附制氮裝置相比,價格要高出30%左右,故由膜分離制氮和氮純化裝置相組合製取
高純氮時,普氮純度一般為98%,因而會增加純化裝置的製作成本和運行成本。
氮氣純化方法
加氫除氧法
在催化劑作用下,普氮中殘餘氧和加入的氫發生
化學反應生成水,其反應式:2H
2+O
2=2H
2O,再通過後級乾燥除去水份,而獲得下列主要成份的
高純氮:N
2≥99.999 %,O
2≤5×10-6,H
2≤1500×10
-6,H
2O≤10.7×10
-6。制氮成本在0.5元/m
3左右。
加氫除氧、除氫法
此法分三級,第一級加氫除氧,第二級除氫,第三級除水,獲得下列組成的
高純氮:N
2≥99.999%,O
2≤5×10
-6,H
2≤5×10
-6,H
2O≤10.7×10
-6。制氮成本在0.6元/m3左右。
碳脫氧法
在碳載型催化劑作用下(在一定溫度下),普氮中之殘氧和催化劑本身提供的碳發生反應,生成CO2。反應式:C+O2=CO2。再經過後級除CO2和H2O獲得下列組成的高純氮氣:N2≥99.999%,O2≤5×10-6,CO2≤5×10-6,H2O≤10.7×10-6。制氮成本在0.6元/m3左右。
優劣評比
上述三種氮氣純化方法中,方法(1)因成品氮中H2量過高滿足不了磁性材料的要求,故不採用;方法(2)成品氮純度符合磁性材料用戶的要求,但需氫源,而且氫氣在運輸、貯存、使用中都存在不安全因素;方法(3)成品氮的質量完全可滿足磁性材料的用氣要求,工藝中不使用H
2,無
加氫法帶來的問題,氮中無H
2且成品氮的質量不受普氮波動的影響,故和其他氮氣純法相比,氮氣質量更加穩定,是最適合磁性材料行業中一種氮氣純化方法。
注意事項
危險性
危險性類別:第2.2類 惰性氣體
侵入途徑:吸入
健康危害:空氣中氮氣含量過高,使吸入氣氧分壓下降,引起缺氧窒息。吸入氮氣濃度不太高時,患者最初感胸悶、氣短、疲軟無力;繼而有煩躁不安、極度興奮、亂跑、叫喊、神情恍惚、步態不穩,稱之為“氮酩酊”,可進入昏睡或昏迷狀態。吸入高濃度,患者可迅速昏迷、因呼吸和心跳停止而死亡。
潛水員深潛時,可發生氮的麻醉作用;若從高壓環境下過快轉入常壓環境,體內會形成氮氣氣泡,壓迫神經、血管或造成微血管阻塞,發生“減壓病”。
環境危害:無
燃爆危險:本品不燃。
急救措施
皮膚接觸:沒事(因空氣中就含有約78%的氮)
眼睛接觸:沒事(理由同上)
吸入:(濃度較高時)迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。呼吸心跳停止時,立即進行人工呼吸和胸外心臟按壓術。就醫。
消防措施
危險特性:若遇高熱,容器內壓增大,有開裂和爆炸的危險。
有害燃燒產物:氮氣。
滅火方法:本品不燃。儘可能將容器從火場移至空曠處。噴水保持火場容器冷卻,直至滅火結束用霧狀水保持火場中容器冷卻。可用霧狀水噴淋加速
液氮蒸發,但不可使用水槍射至液氮。
泄漏應急處理
應急處理:迅速撤離泄漏污染區人員至上風處,並進行隔離,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿一般作業工作服。儘可能切斷泄漏源。合理通風,加速擴散。漏氣容器要妥善處理,修復、檢驗後再用。
操作處置儲存
操作注意事項:密閉操作。密閉操作,提供良好的自然通風條件。操作人員必須經過專門培訓,嚴格遵守操作規程。防止氣體泄漏到工作場所空氣中。搬運時輕裝輕卸,防止鋼瓶及附屬檔案破損。配備泄漏應急處理設備。
儲存注意事項:儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。儲區應備有泄漏應急處理設備。
接觸控制
監測方法:
工程控制:密閉操作。提供良好的自然通風條件。
呼吸系統防護:一般不需特殊防護。當作業場所空氣中
氧氣濃度低於18%時,必須佩戴空氣呼吸器、長管面具。
眼睛防護:一般不需特殊防護。
身體防護:穿一般作業工作服。
手防護:戴一般作業防護手套。
其它防護:避免高濃度吸入。進入罐、限制性空間或其它高濃度區作業,須有人監護。
相關數據
外觀與性狀:無色無臭氣體。
溶解性:難溶於水、乙醇。
主要用途:用於合成氨,制硝酸,用作物質保護劑,冷凍劑。
pH值:
熔點(℃):-209.8
相對密度(水=1):0.81(-196℃)
沸點(℃):-195.6
相對蒸氣密度(空氣=1):0.97
閃點(℃):無意義
辛醇/水分配係數:無資料
引燃溫度(℃):無意義
爆炸下限[%(V/V)]:無意義
臨界溫度(℃):-147
爆炸上限[%(V/V)]:無意義
臨界壓力(MPa):3.40
飽和蒸氣壓(kPa):1026.42(-173℃)
其它理化性質: |
反應活性
穩定性:穩定
禁配物:無
避免接觸的條件:無
聚合危害:聚合
燃燒(分解)產物:氮氣。
毒理學資料
LC50:無資料
刺激性:無資料
致敏性:無資料
致突變性:無資料
致畸性:無資料
其它:無資料。
生態學資料
生態毒性:無資料
非生物降解性:無資料
其它有害作用:無資料
廢棄處置
廢棄處置方法:處置前應參閱國家和地方有關法規。廢氣可以直接排入大氣。
運輸信息
危險貨物編號:22005
UN編號:1066
包裝標誌:不燃氣體
包裝類別:O53
包裝方法:鋼質氣瓶;安瓿瓶外普通木箱。
運輸注意事項:採用鋼瓶運輸時必須戴好鋼瓶上的安全帽。鋼瓶一般平放,並應將瓶口朝同一方向,不可交叉;高度不得超過車輛的防護欄板,並用三角木墊卡牢,防止滾動。嚴禁與易燃物或可燃物等混裝混運。夏季應早晚運輸,防止日光曝曬。鐵路運輸時要禁止溜放。
法規信息
法規信息:
危險化學品安全管理條例(國務院第344號令),工作場所安全使用化學品規定 ([1996]勞部發423號)等法規,針對化學危險品的安全使用、生產、儲存、運輸、裝卸等方面均作了相應規定;常用危險化學品的分類及標誌(GB 13690-92)將該物質劃為第2.2 類不燃氣體。
氮的氧化物
氮可以形成多種不同的氧化物。在氧化物中,氮的
氧化數可以從+1到+5。其中以NO和
NO2較為重要。
氮的氧化物的性質如下表:
| 名稱 | 化學式 | 狀態 | 顏色 | 化學性質 | 熔點(℃) | 沸點(℃) | 一般用途 |
|---|
| N2O | | 無色 | 常溫下穩定,註:即是笑氣 | -90.8 | -88.5 | 火箭和賽車的氧化劑及增加發動機的輸出功率。 |
| NO | 氣態 | 無色(固態、液態時為藍色) | 反應能力適中,強還原性 | -163.6 | -151.8 | 引起血管的擴張而引起勃起和生產硝酸 |
| N2O3 | 液態 | 藍色 | 室溫下分解為NO和NO2 | -102 | -3.5(分解) | 生產亞硝酸 |
| NO2 | 氣態 | 紅棕色 | 強氧化性 | -11.2 | 21.2 | 生產硝酸 |
| N2O4 | 氣態 | 無色 | 室溫下強烈地分解為NO2
註:即是二氧化氮二聚體 | -92 | 21.3 | 火箭推進劑組分中的氧化劑 |
| N2O5 | 固態 | 白色 | 不穩定 | 30 | 47(分解) | 生產硝酸 |
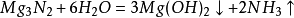
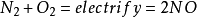
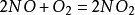
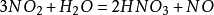
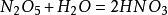
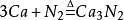

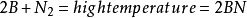
 氮氣的用途
氮氣的用途