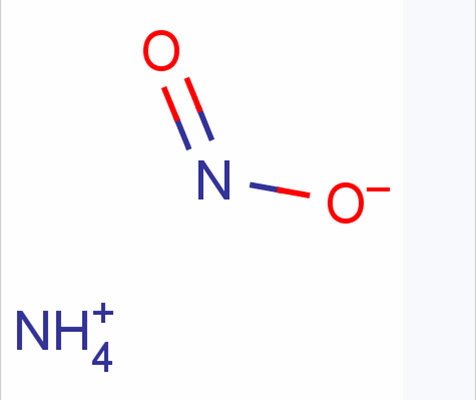
理化性質
外觀與性狀:白色至黃色菱形晶體。
主要用途:是氨氧化過程的中間體。
 亞硝酸銨顆粒
亞硝酸銨顆粒 熔點:60~70(分解爆炸)
相對密度(水=1):1.69
溶解性:易溶於水、稀鹼液和乙醇,不溶於醚。
升華點℃:30(真空中)避免接觸的條件:受熱分解。
燃燒性:助燃建規
火險分級:甲
危險特性:強氧化劑。受熱或震動撞擊時可發生爆炸。與有機物、還原劑、易燃物如硫、磷等接觸時,有引起燃燒爆炸的危險。受熱分解,放出高毒的煙氣。
燃燒(分解)產物:氮氧化物、氨。
穩定性:不穩定
聚合危害:不能出現
禁忌物:強還原劑、易燃或可燃物。
遇高溫(60℃以上)、猛撞, 以及與易燃物、有機物接觸, 有發生爆炸的危險。
滅火方法:霧狀水、砂土。
危險性類別:第5.1類
氧化劑危險貨物包裝標誌:11
相似物質對比
亞硝酸銨與亞硝酸鹽
亞硝酸鹽,一類無機化合物的總稱。主要指
亞硝酸鈉,亞硝酸鈉為白色至淡黃色粉末或顆粒狀,味微鹹,易溶於水。硝酸鹽和亞硝酸鹽廣泛存在於人類環境中,是自然界中最普遍的含氮化合物。人體內硝酸鹽在微生物的作用下可還原為亞硝酸鹽,N-亞硝基化合物的前體物質。外觀及滋味都與
食鹽相似,並在工業、建築業中廣為使用,肉類製品中也允許作為發色劑限量使用。由亞硝酸鹽引起食物中毒的機率較高。食入0.3~0.5克的亞硝酸鹽即可引起中毒,3克導致死亡。
亞硝酸銨是屬於亞硝酸鹽中的一種。
製備方法
(1)用NH4ClO4溫溶液跟KNO2溫溶液混和冷卻,析出難溶的KClO4晶體,製得NH4NO2溶液。
(2)用碳酸銨溶液吸收氧化氮氣體製取亞硝酸銨。
NO+NO2 + (NH4)2CO3→2NH4NO2+ CO2 (液相)
副反應
2NO2+ (NH4)2CO3→NH4NO2+NH4NO3+CO2(液相)
NO+NO2+2NH3→NH4NO2+N2+H2O(氣相)
2NO2+2NH3→NH4NO3+N2+H2O(氣相)
儲運注意事項
(1)應儲存於陰涼、通風倉間內。
(3)應防止陽光直射。
(4)應與酸類、
還原劑、易燃物、可燃物等分開存放。
(5)操作現場不得吸菸、飲水、進食。
(6)搬運時要輕裝輕卸,防止包裝及容器損壞。
(7)禁止震動、撞擊和摩擦。
(8)分裝和搬運作業要注意個人防護。
毒性危害
毒性危害 接觸限值
(1)中國MAC:未制訂標準;前蘇聯MAC:未制訂標準;美國TLV—TWA:未制訂標準;美國TLV—STEL:未制訂標準。
(2)侵入途徑: 吸入食入經皮吸收
(3)健康危害: 具刺激作用。誤服可引起高鐵血紅蛋白症。受熱分解釋出
氮氧化物和氨煙霧。
(4)急救方法
a、皮膚接觸: 用肥皂水及清水徹底沖洗。就醫。
b、眼睛接觸: 拉開眼瞼,用流動清水沖洗15分鐘。就醫。
c、吸入: 脫離現場至空氣新鮮處。呼吸困難時給輸氧。呼吸停止時,立即進行人工呼吸。就醫。
d、食入: 誤服者,飲適量溫水,催吐。洗胃。就醫。
防護措施
工程控制: 嚴加密閉,提供充分的局部排風或全面排風。
呼吸系統防護: 佩戴防塵口罩。高濃度環境中,應該佩戴防毒面具。
眼睛防護: 戴安全防護眼鏡。
防護服: 穿相應的防護服。
手防護: 戴防護手套。
其他: 工作現場禁止吸菸、進食和飲水。工作後,淋浴更衣。注意個人清潔衛生。
泄漏處置
(1)隔離泄漏污染區,周圍設警告標誌,建議應急處理人員戴好防毒面具,穿化學防護服。
(2)冷卻,防止震動、撞擊和
摩擦,用砂土、乾燥
石灰或蘇打灰混合,收集於一個密閉的容器中,運至廢物處理場所。
(3)用水刷洗泄漏污染區,經稀釋的污水放入廢水系統。
(4)如大量泄漏,收集回收或無害處理後廢棄。
 亞硝酸銨顆粒
亞硝酸銨顆粒