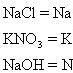基本介紹
原理,概念,說明,作用,書寫事項,
原理
我們接觸到的溶劑大部分是水,因而把能夠在電離過程在水中產生的陽離子都是氫離子的物質叫做酸,電離過程中在水中產生的陰離子都是氫氧根離子的物質叫做鹼。如果我們的思維突破以水為介質,問題類似的轉移,比如在液氨為溶劑的情況下,如果溶質電離只產生陽離子為氫離子的物質就是酸,電離只產生陰離子為氫氧根離子的物質就是鹼了,下面就總結一下經常遇到也是很少遇到一些溶劑本身自偶電離產生的陰陽離子。
概念
電離方程式 (ionization equation)
MgCl2=Mg2+ +2Cl-
NaOH=Na+ + OH-
在以上方程式中,陽離子的正電荷總數和陰離子的負電荷總數的絕對值數量相等。
說明
①物質溶於水或熔融狀態時,離解成自由移動的離子的過程叫做電離。
作用
離子方程式是反映化學反應本質的一種化學方程式,在溶液中,易溶於水的強電解質並不以晶體的形式存在,而是在水分子的作用下,電離成為離子(其實電離以後各離子絕大多數都是和水分子水合成為水合離子,但這是大學內容,在高中只要求寫出水合前的離子,在此不作討論)。溶液中的反應實質上就是離子間的反應,比如說HCl+AgNO3=AgCl↓+HNO3,和NaCl+AgNO3=AgCl↓+NaNO3這兩個反應看似不同,但實質都是氯離子和銀離子生成氯化銀沉澱,用離子方程式就能很清楚地看清楚:Ag++Cl-=AgCl↓。而弱電解質、不易溶於水的強電解質、非電解質或單質在溶液反應中主要還是以分子(或晶體)存在,所以在寫離子方程式時仍然寫分子式。所以離子方程式主要是以物質在溶液中主要的存在形式為根據寫的。
書寫事項
電離方程式根據反應時物質是否以離子的狀態存在。例NaHCO3固體分解時就不能寫成離子形式,在溶液中就可以寫成離子形式。
書寫電離方程式時應特別注意:
①寫出物質正確的化學式是正確書寫電離方程式的基礎。
②要正確書寫出電離的陽離子、陰離子的符號。這裡注意區分離子符號和化合價的書寫。離子所帶電荷的數目應標在元素符號的右上角,且要先寫數字,後寫“+”或“-”號;化合價標在元素符號的正上方,先寫“+”或“-”號,後寫數字。離子的電荷數為1時,1省略不寫,只寫“+”或“-”號;而化合價數為1時,1必須標明。
③含有原子團的物質電離時,原子團應作為一個整體,不能分開。
④表示離子數目的數字要寫在離子符號的前面,不能像在化學式里那樣寫在右下角。