離子方程式,即用實際參加反應的離子符號表示離子反應的式子。是指可溶性物質可拆的反應。多種離子能否大量共存於同一溶液中,歸納起來就是:一色,二性,三特殊,四反應。
基本介紹
- 中文名:離子方程式
- 外文名:ionic equation
- 意義1:揭示離子反應的本質
- 意義2:表示同一類型離子反應
- 原則1:客觀事實原則
- 原則2:質量守恆原則
- 原則3:電荷守恆原則
- 原則4:定組成原則
基本步驟,正誤判斷,依據四原則,看拆分正誤,書寫錯誤,易錯分析,
基本步驟
寫
明確寫出有關反應的化學方程式。
拆
②對於微溶物質來說在離子反應中通常以離子形式存在(溶液中),但是如果是在濁液里則需要寫出完整的化學式,例如,石灰水中的氫氧化鈣寫離子符號,石灰乳中的氫氧化鈣用化學式表示。濃硫酸中由於存在的主要是硫酸分子,也書寫化學式。濃硝酸、鹽酸是完全電離的,所以寫離子式。
刪
刪去方程式兩邊相同的離子和分子。
查
正誤判斷
依據四原則
⑴客觀事實原則
如2Fe + 6H+ == 2Fe3+ + 3H2↑,錯在H+不能把Fe氧化成Fe3+,而只能氧化成Fe2+。應為:Fe + 2H+ == Fe2+ + H2↑。
⑵質量守恆原則
如Na + H2O==Na++ OH- + H2↑,錯在反應前後H原子的數目不等。應為:2Na + 2H2O == 2Na+ + 2OH-+ H2↑。
⑶電荷守恆原則
如Fe3+ + Cu == Fe2+ + Cu2+,錯在左右兩邊電荷不守恆。應為:2Fe3+ + Cu ==2Fe2+ + Cu2+。
⑷固定組成原則
如稀硫酸與Ba(OH)2溶液反應:H+ + SO42- + Ba2+ + OH- == BaSO4↓ + H2O,錯在SO42-和H+,Ba2+和OH-未遵循1:2這一定組成。應為:2H+ + SO42- + Ba2+ + 2OH- ==BaSO4↓ + 2H2O。
看拆分正誤
⑴能拆分的物質
如Ca(HCO3)2 + 2H+ == Ca2+ + 2CO2↑ + 2H2O,錯在未將Ca(HCO3)2拆分成Ca2+和HCO3-。應為:HCO3- + H+== CO2↑ + H2O。
可見:能拆分的物質一般為強酸(如鹽酸HCl)、強鹼(如氫氧化鈉NaOH)、和大多數可溶性鹽(氯化鈉NaCl)。
⑵不能拆分的物質
一、難溶物不拆
例l:向碳酸鈣中加入過量鹽酸。
錯誤:CO32- + 2H+ = CO2 +H2O
原因:CaCO3難溶於水,像BaSO4、.AgCl、Cu(OH)2、H2SiO3等在書寫離子方程式時均不能拆開,應寫成化學式.
正確:CaCO3 + 2H+ == CO2↑ + Ca2+ + H2O
二、微溶物作生成物不拆
錯誤:此反應可發生,但是CaSO4不可拆分。
原因:CaSO4是微溶物,像Ag2SO4、MgCO3、Ca(OH)2等微溶物,若作為生成物在書寫離子方程式時均不能拆開,應寫成化學式。
正確:SO42- + Ca2+ == CaSO4↓
說明:微溶物作生成物,濃度較小時拆成離子式,濃度較大時應寫成化學式。
三、弱電解質不拆
錯誤:Al3+ + 3OH-== Al(OH)3↓
原因:氨水為弱電解質,像H2O、HF、CH3COOH等弱電解質在書寫離子方程式時均不能拆開,應寫成化學式。
正確:Al3+ + 3NH3·H2O == Al(OH)3↓+ 3NH4+
四、氧化物不拆
例4:將氧化鈉加入水中。
錯誤:O2- + H2O==2OH-
原因:Na2O是氧化物,氧化物不論是否溶於水在書寫離子方程式時均不能拆開,應寫成化學式。
正確:Na2O+H2O == 2Na+ + 2OH-
五、弱酸的酸式酸根不拆
例5:向碳酸氫鈉溶液中加入稀鹽酸。
錯誤:2H+ + CO32- ==CO2↑+ H2O
原因.HCO3-是弱酸H2CO3的酸式酸根,像HSO3-,、HS-、H2PO4-等離子在書寫離子方程式時均不能拆開,應寫成化學式。
正確:HCO3- + H+ == CO2↑ + H2O
注意:對於強酸的酸式鹽,如NaHSO4其陰離子在稀溶液中應拆開寫成
H+與SO42-形式,在濃溶液中不拆開,仍寫成HSO4-。
六、固相反應不拆
例6:將氯化銨固體與氫氧化鈣固體混合加熱。
錯誤:NH4+ + OH- ==NH3↑ + H2O
正確:2NH4Cl+Ca(OH)2 == CaCl2 + 2NH3↑ +2H2O(化學反應方程式)
七、非電解質不拆
蔗糖、乙醇等大多數有機物是非電解質,在書寫離子方程式時均不能拆開,應寫分子式。
書寫錯誤
不符合客觀事實
如:
Fe與HCl反應寫成“2Fe + 6H+ === 2Fe3+ + 3H2↑”
稀H2SO4與Ba(OH)2反應寫成“Ba2++ OH-+ H++SO42- === BaSO4↓ + H2O”
配平有誤
質量不守恆,如:Zn+2Fe3+=== Fe+3Zn2+
電荷不守恆,如:Al+2H+=== Al3++H2↑
電子不守恆,如:2MnO4-+3H2O2+6H+=== 2Mn2++5O2↑+8H2O
拆分有誤:如醋酸與碳酸鈣反應寫成“CO32-+2H+=== CO2↑+H2O”
分析量的關係
如把過量的NaHCO3溶液與Ca(OH)2溶液混合:HCO3- + Ca2+ + OH- ==== CaCO3↓ + H2O,錯在未考慮反應物中量的關係。應為:2HCO3- + Ca2+ + 2OH- ==== CaCO3↓ + 2H2O +CO32-。
查看是否有忽略隱含反應
如將少量SO2通入漂白粉溶液中:H2O + SO2 + Ca2+ + 2ClO- ==== CaSO3↓ + 2HClO,錯在忽略了HClO可以將+4價的硫氧化。應為:Ca2+ + 2ClO- + SO2 + H2O ==== CaSO4↓ + H+ + Cl- + HClO。
易錯分析
概述
①所有氧化物和過氧化物一律寫化學式,初學者易忽略只有易溶且易電離的電解質用離子符號表示,往往將許多不可溶的強電解質拆開,導致錯誤。這裡必須清楚,像過氧化鈉、氧化鈉等活潑金屬氧化物或過氧化物,雖然是易溶的電解質但是不可拆。
32種易誤拆而不能拆的物質
BaCO3 | CaCO3 | MgCO3 | Ag2CO3 | FeS | CuS | Fe(OH)3 | Cu(OH)2 |
Al(OH)3 | Mg(OH)2 | NH3·H2O | AgCl | AgBr | CH3COOH | HF | HClO |
H2CO3 | H2S | H2SO3 | MnO2 | CuO | Fe2O3 | Al2O3 | Na2O |
Na2O2 98%濃硫酸 | 石灰乳Ca(OH)2 |
不能拆的酸式弱酸根離子有:
HCO3- | HS- | HSO3- | H2PO4- | HPO42- |
注意:當Ca(OH)2為澄清石灰水時要拆,為石灰乳時不拆
判斷溶液中離子能否大量共存的規律
特殊多種離子能否大量共存於同一溶液中,歸納起來就是:一色,二性,三,四反應。
1.一色--溶液顏色
若限定無色溶液,則Cu2+,Fe2+,Fe3+,MnO4-,Cr2O72-等有色離子不能存在。
2.二性--溶液的酸,鹼性
⑴在強酸性溶液中,OH-及弱酸根陰離子(如CO32-,SO32-,S2-,CH3COO-等)不能大量存在。
⑵在強鹼性溶液中,弱鹼陽離子(如NH4+,Al3+,Mg2+,Fe3+等)不能大量存在。
⑶酸式弱酸根離子(如HCO3-,HSO3-,HS-)在強酸性或強鹼性溶液中均不能大量存在。
3.三特殊--三種特殊情況
⑴AlO2-與HCO3-不能大量共存:
AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
⑶NH4+與CH3COO-,CO32-,Mg2+與HCO3-等組合中,雖然兩種離子都能水解且水解相互促進,但總的水解程度很小,它們在溶液中能大量共存(加熱就不同了)。
4.四反應--四種反應類型
指離子間通常能發生的四種類型的反應,能相互反應的離子顯然不能大量共存。
如Ba2+與SO42-,NH4+與OH-,H+與CH3COO-等
⑵氧化還原反應
如Fe3+與I-,NO3-(H+)與Fe2+,MnO4-(H+)與Br-等
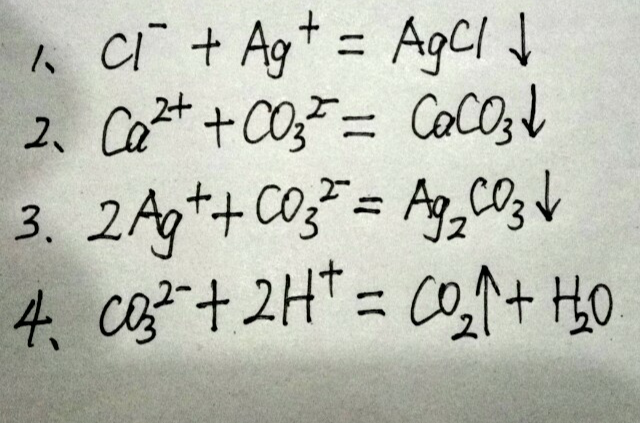
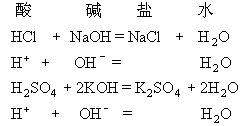 離子方程式
離子方程式