基本介紹
簡介
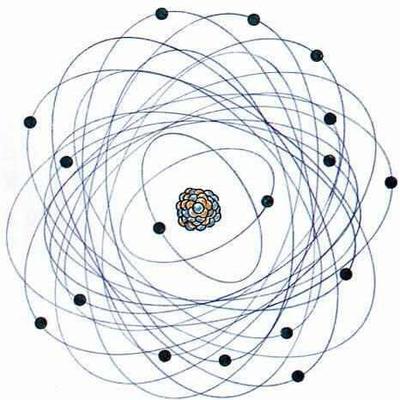 電子殼層圖片
電子殼層圖片電子殼層結構
核外電子分布原理與研究

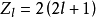
 電子殼層圖片
電子殼層圖片
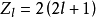
原子內的電子都各自處在由幾個量子數所表征的確定能量狀態中,電子殼層是所有具有同一給定主量子數(或具有同一給定主量子數及同一給定軌道角動量量子數)的電子態...
關於原子內電子排布的一種簡化模型。...... 原子內的電子按一定的殼層排列,每一殼層內的電子都有相同的主量子數,每一個新的周期是從電子填充新的主殼層開始,元素...
殼層模型是模擬原子內結構的結構模型。...... 核殼層模型部分是類似於原子的電子殼層描述原子中的電子的安排,當殼層填滿時特別穩定,核殼層模型描述原子中次原子粒子的...
在核物理與核化學中,核殼層模型是一個利用泡利不相容原理的結構來描述的原子核的能量級別的一個模型。原子核殼模型是邁耶(M.G.Mayer)夫人和簡森(J.H.D.Jensen...
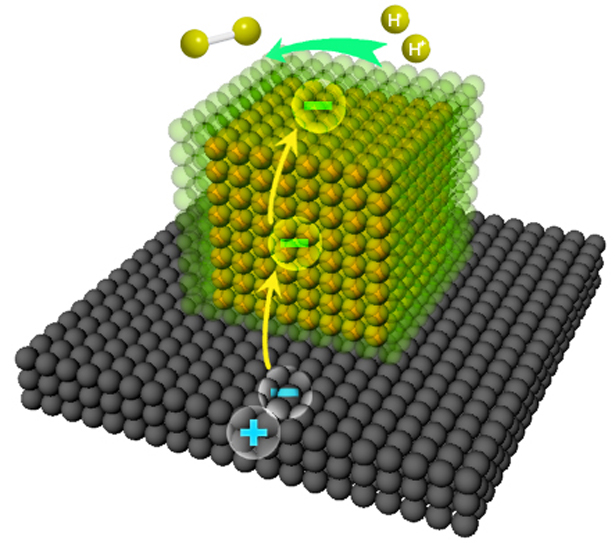
電子共有化運動定義:原子組成晶體後,由於電子殼層的交疊,電子不再完全局限在某一個原子上,可以由一個原子轉移到相鄰的原子上去,因而,電子將可以在整個晶體中運動...
孤電子對(英語:lone pair,或稱孤對電子)是不與其他原子結合或共享的成對價電子。存在於原子的最外圍電子殼層。 孤對電子在分子中的存在和分配影響分子的形狀等,...
電子磁偶極矩 是在原子物理學中由電子自身自旋特性所引起的電子的磁矩 。電子磁偶極矩的值為−9284.764 × 10^−27 J.T^-1。最近量測到的電子磁偶極矩...
β粒子(英語:Beta particle),又譯貝塔粒子或貝他粒子即是指當放射性物質發生β衰變,β衰變就是原子核自發地放射出β粒子或俘獲一個軌道電子而發生的轉變。放出...
磁共振指的是自旋磁共振(spin magnetic resonance)現象。其意義上較廣,包含核磁共振(nuclear magnetic resonance, NMR)、電子順磁共振(electron paramagnetic resonance...
這時原子被激發,稱為受激原子。當原子獲得更大能量時,可能有一個或多個電子脫離核的束縛成為自由電子,使原子(或分子)成為帶正電荷的系統,稱為正離子。...
