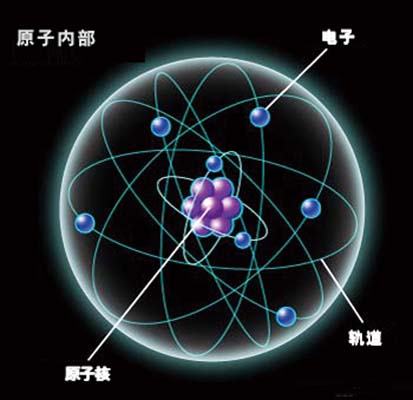
關於原子內電子排布的一種簡化模型。
基本介紹
- 中文名:原子殼層結構
- 外文名:atomic shell structure
原子殼層結構含義,電子填充殼層結構的原則:,各殼層所能容納的最大電子數,各元素的原子殼層結構,簡介,
原子殼層結構含義
把原子中具有相同n值量子數的電子集合,稱為一個殼層。在同一個殼層中,具有不同軌道角動量量子數的電子的集合,稱為次殼層。電子殼層按主量子數n=1,2,3,4,5,6,7的數值分別稱為K,L,M,N,O,P,Q層。
原子內的電子按一定的殼層排列,每一殼層內的電子都有相同的主量子數,每一個新的周期是從電子填充新的主殼層開始,元素的物理、化學性質取決於原子最外層的電子即價電子的數目。
電子填充殼層結構的原則:
1、泡利不相容原理:在一個原子中,不可能有兩個或兩個以上的電子具有完全相同的狀態(完全相同的四個量子數)。
推論:
(1)、一個原子中,四個量子數完全相同的電子只能有一個。
(2)、具有相同量子數的電子最多能有兩個,它們的第四個量子數分別為±1/2。
1、能量最小原理:原子在正常狀態時,每個電子在不違背泡利不相容原理的前提下,總是趨向占有最低能量的狀態,以使原子系統的能量具有最小值。也就是說,電子按能量由低到高的次序填充各殼層。
各殼層所能容納的最大電子數
1、n、l相同的次殼層:N1=2(2l+1)
2、n相同的主殼層:Nn==2
各元素的原子殼層結構
1、元素周期表第一周期:從n=1的K殼層填起。
2、元素周期表第二周期:從n=2的L殼層填起。
3、元素周期表第三周期:從n=3的M殼層填起。
簡介
原子內帶正電的密實部分集中於一個很小的核,帶負電的電子分布於核外,中性原子的核外電子數等於原子序數Z。Z個電子在核外如何分布是物理學和化學感興趣的問題。按照量子力學,原子內的電子可處於各種可能的定態,電子的運動狀態由n、l、ml、ms4個量子數描述。這4個量子數的取值規則是主量子數取正整數1、2、3、4、5…;對於每個n,角量子數l可取0、1、2、…n-1,共n個值;對於每個l,磁量子數m可取-l、-l+1、…、l,共2l+1個值,自旋磁量子數ms取+1/2,或-1/2?。具有相同主量子數n的電子構成一個殼層,相同n按不同l又分為若干個支殼層,對應於l=0、1、2、…的支殼層分別用s、p、d、f、g、h等來表示。原子核外電子的排布遵從兩條規律:①泡利不相容原理。原子內不可能有兩個或兩個以上的電子具有完全相同的四個量子數。由此可確定原子內每個支殼層可容納的電子數為2(2l+1)個,每個殼層可容納的電子數為2n2個,對於第1、2、3、4等殼層可容納的電子數分別為2、8、18、32、50。②能量最低原理。電子儘可能先填充能量較低的狀態,各狀態能量高低的順序可由經驗規律 n+0.7l值的大小加以判斷。由此可以確定隨著原子序數增大,核外電子填充支殼層的順序是:
1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f…電子的殼層排布與元素周期表一致,很好地說明元素的物理、化學性質周期性根源是原子內電子的殼層排布。