基本介紹
- 中文名:主量子數
- 外文名:principal quantum number
- 定義:與能層對應的量子數叫主量子數
- 學科:物理、化學
- 涉及:量子
- 範疇:量子力學術語
基本性質
 原子電子分布圖
原子電子分布圖 圖1
圖1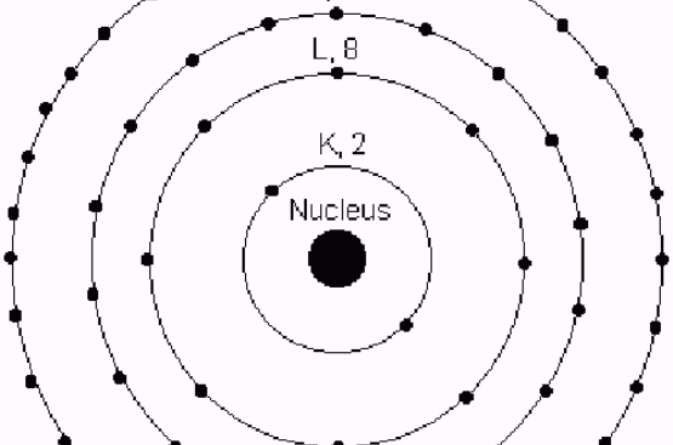
 原子電子分布圖
原子電子分布圖 圖1
圖1主量子數是原子物理學中的概念,是與能層對應的量子數,表示原子軌道的量子數的其中一種(其他還包括角量子數、磁量子數和自旋量子數),用小寫字母n表示。...
量子數(quantum number)是量子力學中表述原子核外電子運動的一組整數或半整數。因為核外電子運動狀態的變化不是連續的,而是量子化的,所以量子數的取值也不是連續的...
也就是這個系統的主量子數,此時 。[1] 徑向量子數基本原理 編輯 在原子結構的研究中,電子在核場中運動時的勢函式往往是一個徑向函式,即其中...
軌域量子數l又稱角動量量子數、方位量子數、系列量子數,它是決定軌域型別或形狀的角動量常數,它可能是包括0在內的整數,與主量子數n的關係為l=0,1,2,3``...
例如,在計算氫原子能譜時,能級與主量子數{\displaystyle n}有關,所以,每個量子態的態矢量可以表示為{\displaystyle |n\rangle }。...
電子層,或稱電子殼,是原子物理學中,一組擁有相同主量子數n的原子軌道。電子在原子中處於不同的能級狀態,粗略說是分層分布的,故電子層又叫能層。...
原子軌道是單一原子的波函式,使用時必須代入n(主量子數)、l(角量子數)、m(磁量子數)三個量子化參數,分別決定電子的能量、角動量和方位,三者統稱為量子數。...
主量子數描述電子離核的遠近,確定原子的能級或確定軌道能量的高低。決定軌道或電子云的分布範圍。一般,n 值越大,電子離核越遠,能量越高。主量子數所決定的電子...
帕申系(也稱為里茲-帕申系)是物理學上氫原子的電子從主量子數n大於或等於4躍遷至n = 3的一系列光譜線。這些系列以希臘字母依序標示:n = 4躍遷至n = 3稱...
主量子數、角量子數、磁量子數都是薛丁格方程的解。要完整描述電子狀態,必須要四個量子數。自旋磁量子數不是薛丁格方程的解,而是作為實驗事實接受下來的。...
主條目:原子軌道作為薛丁格方程的解,原子軌道的種類取決於主量子數(n)、角量子數(l)和磁量子數(ml)。其中,主量子數就相當於電子層,角量子數相當於亞層,而磁...
其中, R是里德伯常量,ni 與 nf分別是初始能級與最終能級的主量子數,ni>nf。 [2] 波數電磁波 編輯 電磁波,是由同相且互相垂直的電場與磁場在空間中衍生髮射...
C.K.英戈爾德稱這種效應為中介效應,並且認為,共軛體系中這種電子的位移是由有關各原子的電負性和p軌道的大小(或主量子數)決定的。Y原子的電負性和它的p軌道半徑...
層,因此元素原子的電子層數等於該元素在周期表中所處的周期數、還等於該元素的原子核外電子的最高能級所在能級組數,也就是說等於原子的最外電子層的主量子數。...
英戈爾德,C.K.稱這種效應為仲介效應,並且認為,共軛體系中這種電子的位移是由有關各原子的電負性和 p 軌道的大小(或主量子數)決定的。...
在主量子數相同時,成鍵能力大的軌道形成的共價鍵較牢固。氫分子中的化學鍵量子力學計算表明,兩個具有電子構型的H彼此靠近,兩個1s電子以自旋相反的方式形成電子對,...
