優勢,發展,分類,經典方法,按激發信號分,IUPAC方法,主要用途,化學電池,原電池,電池的表示,電位介紹,極化和過電位,濃差極化,過電位,電極去極化,電極的種類,金屬基電極,難溶鹽電極,M,零類電極,膜電極,發展和展望,
優勢 2) 元素
形態分析 :如Ce(III)及Ce(IV)分析
3) 產生電信號,可直接測定。儀器簡單、便宜;
4) 多數情況可以得到化合物的
活度 而不只是濃度,如在生理學研究中,Ca2+或K+的活度大小比其濃度大小更有意義;
發展 50年代,I.M. Kolthoff提出:ElectroanalyticalChemistry as the application of electrochemistry to analytical chemistry。
80年代,J.A.Plambeck 修正了這一定義:
Electroanalytical chemistry is that branch of chemical analysis that employs electrochemical methods to obtain information related to the amounts,properties,and environments of chemical species.
在中國早期引用Kolthoff 的定義
80年代後,提出的中文定義為:“依據電化學和分析化學的原理及實驗測量技術來獲取物質的質和量及狀態信息的一門科學。”
將
化學變化 與電的現象緊密聯繫起來的學科便是電化學。套用電化學的基本原理和實驗技術,依據物質的電化學性質來測定物質組成及含量的分析方法稱之為
電化學分析 或電分析化學。
分類 概括為:
成分分析 和形態分析;動力學和
機理分析 ;表面和界面分析等方面的內容.現有方法約200種.在科學研究,工農業生產,幾乎處處都有電分析方法的套用.
經典方法 按原理命名,劃分為五大類
(2)電位分析(E=k+SlogC),
按激發信號分 二.分類(三種分類方法)
IUPAC方法 按電極反應本質分類
(3)有電極反應.
這類方法,IUPAC建議,劃分成三類(1)施加恆定激發信號,
(2)施加可變的大振幅激發信號,(3)施加小振幅度激發信號.
主要用途 按傳統分類原理
a、
電導分析法 :以測量溶液的電導為基礎的分析方法。包括直接
電導法 和
電導滴定法 。直接電導法:是直接測定溶液的電導值而測出被測物質的濃度。
電導滴定法:是通過電導的突變來確定
滴定終點 ,然後計算被測物質的含量。
特點:1.可用於微量成分的測定
3.選擇性很好
特點:選擇性差,僅能測定水-電解質二元混合物中電解質總量,但對水的純度分析有特殊意義
c、
庫侖分析法 :套用外加電源
電解 試液,根據電解過程中所消耗的電量來進行分析的方法
特點:不需標準試樣,準確度高,選擇性好
d、
電解分析法 :套用外加電源
電解 試液,電解後稱量在電極上析出的金屬的質量,依此進行分析方法。也稱電
重量法 。
e、
伏安法 和
極譜法 :兩者都是以電解過程中所得的電—電壓曲線為基礎來進行分析的方法。
2.可同時測定多種金屬離子和有機化合物
3.選擇性好
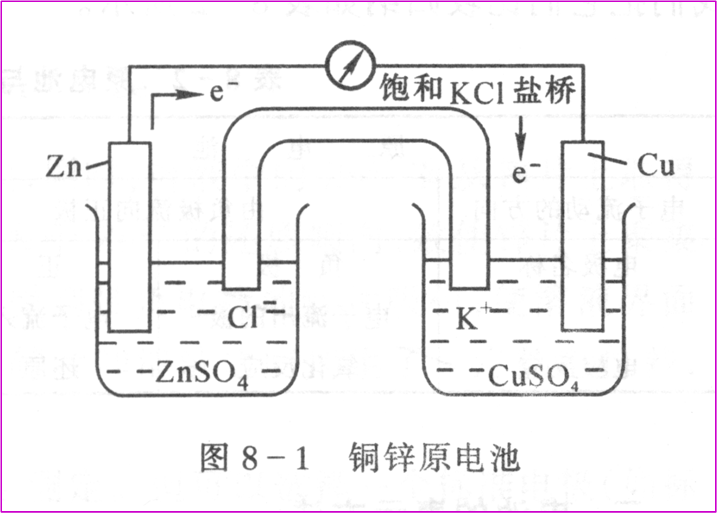
化學電池 原電池——將化學能轉變成電能的裝置。
原電池 負極 Zn=Zn2+ + 2e-
正極 Cu2++2e-=Cu
總反應 Zn+Cu2+= Zn2++Cu
圖8.1 Cu-Zn
原電池 示意圖
兩個條件:
1.
反應物 中的氧化劑和還原劑須分隔開來,不能使其直接接觸;
2.電子由還原劑傳遞給氧化劑要通過溶液之外的導線(
外電路 )
圖8.2 Cu-Zn
電解池 示意圖1-素燒瓷片或
鹽橋 ;2-外電源
將外電源接到Cu— Zn
原電池 上,如果外電源的電壓稍大於Cu-Zn原電池的
電動勢 ,且方向相時,
則
外電路 電子流動方向只能按外電源的極性而定.此時,
兩極 的
電極反應 與原電池的情況恰恰相反.發生
而電極的正和負是由兩電極二者相比較,正者正,負者為負.也就是說,陽極不一定是正極,負極也不一定是陰極.
電池的表示 Zn|ZnSO4(xmol/L) || CuSO4(ymol/L)|Cu
電解池 Cu|CuSO4(ymol/L) || ZnSO4(xmol/L)| Zn
電池電動勢 E電池= φ右-φ左
寫電池式的規則:
(2) 電極的兩相界面和不相混的兩種溶液之間的界面,都 用單豎線"|"表示.當兩種溶液通過
鹽橋 連線時,已消除
液接電位 時,則用雙豎線"‖"表示.
(3)電解質位於兩電極之間.
(4)氣體或均相
電極反應 ,反應本身不能直接作電極,要用惰性材料作電極,以
傳導電流 ,在表示圖中要指出何種電極材料(如Pt,Au,c等).
(5)電池中的溶液應註明濃(活)度,如有氣體則應註明壓力,溫度,若不註明系指攝氏25oC和1大氣壓.
電位介紹 電極電位
電極:在
電化學電池 中賴以進行
電極反應 和
傳導電流 從而構成迴路的部分。電極的
電極電位 :在電極與溶液的兩相界面上,存在的電位差即為電極的電極電位。一個
化學電池 包括有各種物質相的接觸,如固體一溶液,溶液一溶液,固體一固體,溶液一氣體等.在兩相接觸的界面上,它們的性質與相內是不同的.無論是哪種相間的接觸,在它們的界面上都存在著電位差.兩不同物相間的電位差,稱為電極電位.
電極電位的測量:選用
標準氫電極 為標準,規定它的電極電位在任何溫度下的電極電位等於零。然後將其它電極與它組成
原電池 ,通過測定此原電池的
電動勢 ,就可以得到其它電極相對於標準氫電極的電極電位值。
(固-液兩相接觸的瞬間)
圖8.4 相間由離子吸附產生電位差示意圖
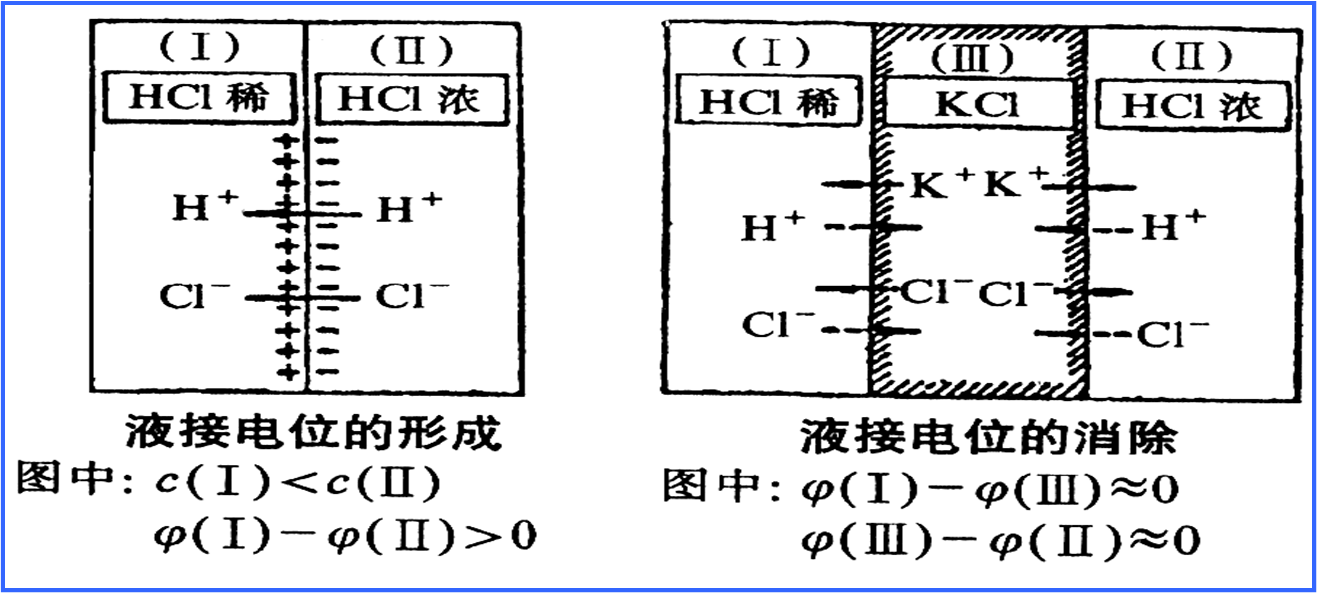
(二),液接電位的消除——
鹽橋 (Salt bridge)
鹽橋的製作:加入3%
瓊脂 於飽和
KCl 溶液(4.2M),加熱混合均勻,注入到U形管中,冷卻成凝膠,兩端以多孔沙芯(porous plug)密封防止
電解質溶液 間的虹吸
而發生反應,但仍形成電池迴路.由於K+和Cl-離子的遷移或
擴散速率 相當,因而液接電位很小.通常為 1 2 mV.
圖8.6 液體接界電位
(1)作用
(2)使用條件
a.鹽橋中電解質不含有被測離子.
c.要保持鹽橋內
離子濃度 的
離子強度 5~10倍於被測溶液.常用作鹽橋的電解質有:
KCl ,NH4Cl,KNO3等.
試液‖KCl(飽和~4mol/L)|Hg2Cl2,Hg
對 電極反應 : aA+bB+ ­;… +ne=cC+dD … 其電極電位可由下式計算:E=E⊙+RTIn(AaAb/AcAd)/NF
極化和過電位 濃差極化 在
陰極 附近,
陽離子 被快速還原,而主體溶液陽離子來不及擴散到電極附近,陰極電位比可逆電位更負;在
陽極 附近,電極被氧化(溶解),離子來不及離開,陽極電位比可逆電位更正。
發生電極反應時,電極表面附近溶液濃度與主體溶液濃度不同所產生的現象稱為極化.如
庫侖分析 中的兩支 Pt 電極,
滴汞電極 都產生極化,是
極化電極 .
主要由電極反應動力學因素決定.由於分步進行的
反應速度 由最慢的反應所決定,即克服
活化能 要求外加
電壓比 可逆
電動勢 更大反應才能發生.(在
陰極 ,應使陰極電位更負;在
陽極 應使陽極電位更正).
電化學極化是由於電極反應的速度較慢而引起的.很多電極反應不僅包括有電子轉移過程,還有一系列化學反應的過程.如果其中某一步過程的速度較慢,就限制總的
電極反應 的速度.在
電化學極化 的情況下,流過電極的電流受電極反應的速度限制,而在
濃差極化 時,電流是受傳質過程的速度所限制.
過電位 由於
極化 ,使實際電位和可逆電位之間存在差異,此差異即為
超電位 h,不管是哪種極化,都使陰極的電位較
平衡電位 為負,使陽極的電位較平衡電位為正。在陰極,應使陰極電位更負;在陽極應使陽極電位更正。)
b) T­;,h¯
c) 電極化學成份不同,h不同
d) 產物是氣體的電極,其h大
析出金屬的過電位較小,但當析出物為氣體時,尤其是氫、氧時,過電位都很大。在各種電極上氫、氧的過電位不同。
電極去極化 電極的種類 根據電極的組成體系和作用機理不同分類
以金屬為基體,共同特點是電極上有電子交換髮生的氧化還原反應.可分為以下四種:
金屬基電極 (一) 第一類電極(Electrode of the first kind):亦稱金屬基電極(M Mn+)
電極電位 : E = E° + 0.059V /n lg α M n+
要求: 0(Mn+/M)> 0,如Cu,Ag,Hg 等;其它元素,如Zn,Cd,In,Tl,Sn,雖然它們的電極電位較負,因氫在這些電極上的
超電位 較大,仍可做一些金屬離子的
指示電極 .
特點:因下列原因,此類電極用作指示電極並不廣泛
a)_選擇性差,既對本身
陽離子 回響,亦對其它陽離子回響;
b)_許多這類電極只能在鹼性或
中性溶液 中使用,因為酸可使其溶解;
c)_電極易被氧化,使用時必須同時對溶液作脫氣處理
d) 一些"硬"金屬,如Fe,Cr,Co,Ni.其
電極電位 的重現性差;
e) pM-aMn+作圖,所得
斜率 與理論值(-0.059/n)相差很大,且難以預測;
較常用的金屬基電極有:Ag/Ag+,Hg/Hg22+(
中性溶液 );Cu/Cu2+,Zn/Zn2+,Cd/Cd2+,Bi/Bi3+,Tl/Tl+,Pb/Pb2+(溶液要作脫氣處理).
難溶鹽電極 電極反應 : MX n + n e- = M + n X -
電極電位 : E = E° MX n/ M - 0.059V lg α X -
此類電極可作為一些與電極離子產生
難溶 鹽或穩定
配合物 的陰離子的
指示電極 ; 如對Cl-回響的Ag/
AgCl 和Hg/Hg2Cl2電極,對Y4-回響的Hg/HgY(可在待測
EDTA 試液中加入少量HgY)電極.
M Ag/Ag2C2O4,CaC2O4,Ca2+
電極反應 :Ag2C2O4+2e==2Ag+ + C2O42-
電極電位 : E = K+ 0.059 /2lg α Ca2+
因為:
代入前式得:
簡化上式得:
對於難離解的配合物,如Hg/HgY,CaY,Ca2+電極
電極反應:HgY2- + 2e ===Hg + Y4-
式中比值aHgY/aCaY 可視為常數,
因此得到:
同上例,該電極可用於指示Ca2+活度的變化(測定時,可在
試液 中加入少量HgY).
零類電極 零類電極(Metallic redox indicators),亦稱
惰性電極 .電極本身不發生氧化還原反應,只提供電子交換場所.
如Pt/Fe3+,Fe2+電極,Pt/Ce4+,Ce3+電極等.
電極電位 : E = E° + 0.059V lg (α Fe3+/ α Fe 2+)
可見 Pt 未參加電極反應,只提供Fe3+及Fe2+之間電子交換場所.
膜電極 根據電極所起的作用分類
在
電化學 測試過程中,溶液主體濃度不發生變化的電極,稱為指示電極.如果有較大電流通過,溶液的主體濃度發生顯著的變化的電極,稱為工作電極.
定義:與被測物質無關,
電位 已知且穩定,提供測量電位參考的電極,稱為
參比電極 .前述
標準氫電極 可用作測量標準
電極電位 的參比電極.但因該 種電極製作麻煩,使用過程中要使用氫氣,因此,在實際測量中,常用其它參比電極來代替.
1,
甘汞電極 (Calomel electrode)
定義:甘汞電極由汞,Hg2Cl2和已知濃度(0.1,3.5,4.6M)的
KCl 溶液組成.
電極組成:Hg Hg2Cl2,KCl(xM) ; 如下圖所示.
圖8.7 甘汞電極 (a)233型;(b)217型
1-導線;2-加液口;3-KCI溶液;4-素燒瓷芯;5-鉑絲
6-Hg;7-Hg2CI2
可見,
電極電位 與Cl-的
活度 或濃度有關.當Cl 濃度不同時,可得到具有不同電極電位的參比電極.(注意:飽和
甘汞電極 指 KCl 濃度為4.6M)
電極反應 :Hg2Cl2(s) + 2e == 2Hg(l) + 2Cl-
電極電位:
特點:
a) 製作簡單,套用廣泛;
b) 使用溫度較低(<40oC).但受溫度影響較大.(當T從20oC 25oC時,飽和甘汞電極位從0.2479V 2444V,E=0.0035 V);
c) 當溫度改變時,
電極電位 平衡時間較長;d) Hg(II)可與一些離子產生反應.
適宜於水溶劑
阻抗小,有滲漏,接觸好
適宜非水溶液及粘稠液
定 義:該
參比電極 由插入用AgCl 飽和的一定濃度(3.5M或飽和KCl溶 液)的 KCl 溶液中構成.
電極反應 :AgCl + e == Ag + Cl-
構 成:同甘汞電極,只是將甘汞電極內管中的(Hg,Hg2Cl2+飽和KCl) 換成塗有AgCl的銀絲即可.
特 點:a) 可在高於60oC的溫度下使用;
b) 較少與其它
離子反應 (但可與蛋白質作用並導致與待測物界面的堵塞)
在銀絲或鉑絲上鍍一層純銀,將其洗淨後,以其為
陽極 置於lmol/LHCI中,
電解 約 0.5 h,這時在電極上覆蓋一層淡紫色的AgCI層,再將其放在用AgCI飽和的Cl-溶液,即製得銀一
氯化銀 電極.
圖8.9 銀-氯化銀電極
1-導線;2-Ag-AgCI絲;3-KCI溶液;4-素燒瓷芯
1)電極內部溶液的液面應始終高於試樣溶液液面!(防止試樣對內部溶液的污染或因外部溶液與Ag+,Hg2+發生反應而造成液接面的堵塞,尤其是後者,可能是
測量誤差 的主要來源)
2)上述試液污染有時是不可避免的,但通常對測定影響較小.但如果用此類參比電極測量K+,Cl-,Ag+,Hg2+ 時,其測量誤差可能會較大.這時可用
鹽橋 (不含干擾離子的KNO3或Na2SO4)來克服.
它們提供
電子傳遞 的場所,當通過電流很小時,一般直接由
工作電極 和
參比電極 組成電池,但當電流較大時需採用輔助電極構成三電極系統來測量.
發展和展望 初期階段,方法原理的建立
1801年W.Cruikshank,發現金屬的
電解 作銅和銀的定性分析方法.
1834年M.Faraday 發表"關於電的實驗研究"論文,提出Faraday定律Q=nFM.
1922年,J.Heyrovsky,創立
極譜 學.1925年,志方益三製作了第一台
極譜儀 .1934年D.Ilkovic提出
擴散電流 方程.
(Id = k C)
電分析方法體系的發展與完善
電分析成為獨立方法分支的標誌是什麼呢 就是上述三大
定量關係 的建立.50 年代,
極譜法 靈敏度,和電位法pH測定傳導過程沒有很好解決.
近代電分析方法
固體電子線路出現,從儀器上開始突破,克服充電電流的問題,方波極譜,1952 G.C.Barker提出方波極譜.1966年S.Frant和 J.Ross提出單晶(LaF3)作為F— 選擇電極,"
膜電位 "理論建立完善.其它分析方法,催化波和
溶出法 等的發展,主要從提高靈敏度方面作出貢獻.
時間和空間上體現"快","小" 與"大" .
(1)
化學修飾電極 (chemically modified electrodes)
(3)光譜一電化學方法 ( Electrospectrochemistry)
(4)
超微電極 (Ultramicroelectrodes)
(5)另一個重要內容是微型計算機的套用,使電分析方法產生飛躍.
現代電分析方法
1.已知
電極反應 Ag+ + e- Ag的 為0.799V,電極 反應Ag2C2O4+2e- 2Ag+C2O42-的標準
電極電位 解 提示:
標準電極電位 是電對Ag+/Ag在
化學反應 :2Ag++ C2O42- Ag2C2O4平衡時,[C2O42-]=
1mol·L-1的電極電位.
+0.059lg[Ag+] =
=已知 =0.490V,=0.799,令[C2O42-]=1
得到0.490=0.799+0.59lg(
ksp /1)1/2
lgKsp=-0.309×2/0.059=-10.475
Ksp=3.4 × 10-11
( EAgCl,Ag =0.799V,
氯化銀 的
Ksp =1.8×10-10)
解 提示:標準電極電位是指電極反應中個組分
活度 等於1時的
電極電位 .本題中,Ag和
AgCl 是固體,活度是常數,作為1.故只要計算出[Cl-]=1時銀電極的電極電位,就是該電極反應的標準電極電位.
+0.0591lg[Ag+]
Ag++ Cl-= AgCl↓
當溶液中[Cl-]=1mol·L-1時,可求得Ag+濃度:
[Ag+]=Ksp/ [Cl-]= Ksp於是得到:
= E Ag+,Ag
= +0.0591lg Ksp
=0.799+0.059lg(1.8×10-10)
=0.224V
試問:PH=2時,KMnO4能否氧化Br-和I-,當PH=6時,能否氧化Br-和I-.
解 設[MnO4-]=[Mn2+]得到:
當PH=2時,
故KMnO4可以氧化Br-和I-
當PH=6時,
故KMnO4可以氧化I-,但不能氧化Br-
1.濃度均為1*10-6mol /L的硫,鎳離子,對
氯化銀 晶體
膜電極 的干擾程度,硫 鎳(填>,=或<.已知:
KCl ,Br=KCl,S)
(南開大學2002年)
2.活動載體膜電極的敏感膜是( )
A 晶體膜 B 固態無機物
C 固態有機物 D 液態有機化合物
(南開大學2001年)
A Ag-AgCl電極 B 晶體膜氯電極
(南開大學2003年)
A.提高電極的靈敏度 B. 提高電極的選擇性
C.降低電極的內阻 D.延長電極的使用壽命
(鄭州大學2002年)
6.用
鈣離子 選擇電極測定3.30*10-4 mol/L CaCl2溶液的
活度 ,若溶液中存在0.20mol/L的NaCl.
計算:
(1).由於NaCl的存在所引起的
相對誤差 是多少 (已知KCa2+.Na+ = 0.0016)
(2)欲使
鈉離子 造成的誤差減少至2%,允許NaCl的最高濃度是多少