概念
由於Ag/AgCl電極在高溫高壓水溶液體系中具有很小的
溶解度、極高的
穩定性和
可逆性,且即使在有氫存在的情況下
電極表面也會得到很好的保護,這些特性都是其它電極無法比擬的。因此,人們對 Ag/AgCl 電極的研究更為深入和細緻。
 氯化銀電極
氯化銀電極電化學性能
研究背景
探測開發海洋資源對國民經濟的發展有著重要的意義。然而,一些常規的物探方法將探測對象從陸地延伸到海洋後就失去了較好的探測效果。隨著海洋地球物理研究的深入,人們發現以
電法勘探為基礎的,用電性參數反映海水中介質分布規律的海洋大地
電磁法,能夠提供有價值的信息,而這些信息的測量需要高性能的電場感測器。因為海底電場信號的特點是:(1)由於存在海水層的衰減作用,海底的電場信號比陸上的同類信號要微弱許多,幅度可達mV級;(2) 海底電場信號的頻率成份以中、低頻為主,故信號採集時間相對較長,一般情況下,儀器需放置在海底一星期,甚至更長。所以,水下電場信號的檢測,要求電場感測器具有自噪聲低、測量靈敏度高,同時兼顧耐壓、長期性能穩定等特點。為此,尋找和研製海水中高穩定性的電場
感測器尤為重要。
綜合分析常用的電極並結合深海高壓使用環境的具體要求,研製了Ag/AgCl全固態電極,可以直接把它插入被測海水中,從而避免了
液接電位的產生。就其製作條件、影響電位穩定性因素、電極自噪聲性能等方面進行研究,分析了電極的穩定性和自噪聲性能。
Ag-AgCl電極的製備
按一定的比例將制好的
AgCl和粒度為200
目純度為99. 97%的Ag粉均勻混合、造粒,並在單軸壓力下於圓柱體模具內壓製成電極坯體,在400~600℃下燒結得到初始電極,經打磨和鹽酸活化後與銀棒進行螺紋連線、封裝,製成海洋電場測量電極。
電極的穩定性測試
綜合考慮電極微觀形貌後可知,極差電位主要是由兩個電極的反應活性面積不同引起的,反應活性面積的較大差距導致了極差電位不能控制在指定的範圍內。由電極的工作原理可知,Ag /AgCl電極在海水中存在兩個相界面,即 Ag-AgCl-Cl
-,電極表面的Ag和AgCl分別作為
陽極和
陰極參與反應過程並趨於平衡,即AgCl+e=Ag+Cl。
 圖1 銀粉的SEM照片
圖1 銀粉的SEM照片由於AgCl是一種難溶的鹽,所以反應過程還存在著另一個平衡關係:AgCl→Ag++Cl-。
當有電場信號傳來時,微量電流通過電極界面,上述平衡出現偏離,由
氯離子濃度控制的雙電層遭受破壞,雙電層重新建立平衡,導致極差電位的不穩定。所以極差電位及其穩定性是由電極表面的雙電層決定的,而兩電極表面的成分組成及形貌組織決定了雙電層的分。銀粉的粒度分布在 2~5 μm之間,如圖1所示,則AgCl的顆粒數遠多於銀粉,AgCl的顆粒均勻地分布在銀粉周圍,且小顆粒的AgCl填充在大顆粒的銀粉之間,從而有效地避免了大氣孔的產生,大大提高電極的緻密度及均勻性。如圖2所示,電極表面缺陷少,可以看到AgCl稍微熔化時顆粒之間產生的界面,對於金屬而言,由於晶界存在
勢壘,
電阻率會隨著晶界數量的增加而增加,這歸結於晶界對傳導電子的
散射作用;由於樣品電極內含有較多的銀,電子將通過AgCl界面的散射和銀互動傳遞,使信號有效的傳導。
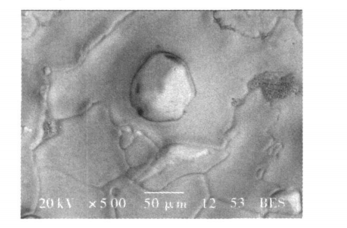 圖2 燒結後電極表面形貌的SEM照片
圖2 燒結後電極表面形貌的SEM照片研究現狀
在進行高溫高壓的
電化學研究中,
參比電極的穩定性對所有的電化學及其相關研究都是至關重要的。九十年代以前,人們就對高溫高壓環境中的參比電極進行了廣泛的研究,各種電極如氫電極、鈀氫化物電極、銀/鹵化銀電極(Ag/AgCl、Ag/AgBr、Ag/AgI等)、金屬/金屬氧化物電極(Hg/HgO、Ag/Ag2O、Pt/PtO、Ir/IrO、Rh/Rh
2O
3、Zr/ZrO2等)、金屬/金屬硫酸鹽電極(Ag/Ag
2SO
4、Hg/Hg
2SO
4、Pt/PtSO
4等)、甘汞電極和不活潑金屬的氧化還原電極(Pt、Ni)等都進行了嘗試和研究,並在相關領域得到了廣泛的套用。但是,由於Ag/AgCl電極在高溫高壓水溶液體系中具有很小的溶解度、極高的穩定性和可逆性,且即使在有氫存在的情況下電極表面也會得到很好的保護,這些特性都是其它電極無法比擬的。因此,人們對Ag/AgCl電極的研究更為深入和細緻,從表1和 Dobson等的研究中可以看出,Ag/AgCl電極不論是在
熱力學或
動力學研究中都得到了廣泛的套用。研究對近幾十年來高溫高壓水溶液體系用Ag/AgCl參比電極的研究進行了回顧和總結,對其發展趨勢進行了分析,並提出了自己的建議。
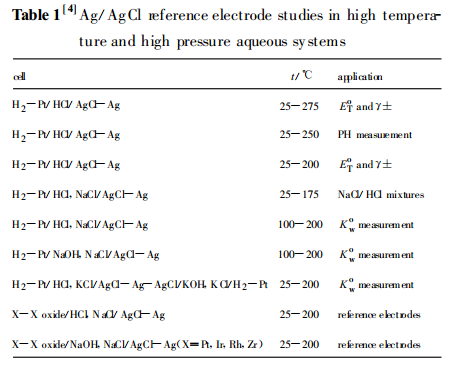 表1 Ag/AgCl參比電極在高溫高壓水相體系中的研究
表1 Ag/AgCl參比電極在高溫高壓水相體系中的研究高溫高壓水溶液體系用參比電極
(1)高溫高壓參比電極的要求
對於任何在高溫高壓體系中套用的
參比電極,都應該滿足以下條件:
1)電極電位有較好的重現性,實驗測試過程中電位穩定。
2)不能與測試體系溶液發生反應。
3)如果參比電極是用於熱力學研究的,它必須具有正確的熱力學行為特徵,滿足
能斯特方程式。
4)電極的
溶解度不能太大;電極材料不會在高溫高壓下發生腐蝕、分解以及影響電極性能的扭曲和形變;液連線部位的材料應在高溫高壓下保持良好的電導通能力和熱穩定性。
當然,在設計和使用參比電極時還應根據實驗的具體要求,詳細考慮液接電位、溶液間的相互作用和污染等一系列的問題。在這一方面,Ives和Janz已經給出了一些關於高溫高壓參比電極設計的建議。
 表2 在高溫和高壓系統中參比電極的優缺點
表2 在高溫和高壓系統中參比電極的優缺點(2)參比電極的形式
高溫高壓用參比電極按電極放置方式可分為內置式和外置式兩大類。前者和工作電極處於相同的溫度、壓力和溶液環境;而後者是把參比電極置於測試體系外部,通過鹽橋和高壓容器內溶液連通。兩種電極由於放置環境的不同,在特性上表現出了很大的差異,表2列舉了兩種參比電極的優缺點。在通常情況下,內置式參比電極多用於電極熱力學行為的研究,而外置式參比電極則多用於電極動力學方面的研究。
高溫高壓用Ag-AgCl內置參比電極結構
高溫高壓水用內置式參比電極在使用上存在的最大問題是電極在短時間內的老化。這和電極體構件之間,以及構件與內部溶液間的
熱膨脹係數差異導致的密封不良、破損和溶液迴路中斷等有關。另外,高溫下Ag/AgCl的水解和AgCl水解產物堵塞液連線部的微孔,也是電極老化的重要原因。有不少工作者從各個方面著手來解決這一問題,比如加循環水冷卻,增加暴露在電極溶液中的Ag的表面積等。Iwamoto等人研製出一種新的複合吸收劑,這種吸收劑是由鹼金屬離子和四苯基硼酸鹽離子(或含氮有機替代物如三胺鹽等)組成,它被填充於多孔性骨架結構如多孔性活性碳或矽膠中,在高溫下它可以阻止Ag/AgCl的水解反應,並且生成的絡合物比原來的離子直徑大而阻止了水解產物堵塞多孔塞微孔的可能性。
高溫高壓用Ag-AgCl外置式參比電極的結構
根據液連線方式的不同,外置式參比電極可以分為以下兩種:第一種是從高溫高壓體系中取出少量的測試液作為連線液,為達到此目的,必須使之不斷的流出,這是一個缺點,但電極結構比較簡單;第二種是採用壓力平衡型外置式參比電極,這種電極的電位可以很方便的換算為SHE基準電位,因此也常被用做基準參比電極。
在液體流出型外置式
參比電極的情況下,為保證液連線的電導通,壓力密封(或稱為壓力接界器)就成為至關重要的問題。壓力密封部分一方面要限制從高壓容器中流出液體的速度,另一方面還要維持熱溶液的電導通。在通常情況下,壓力平衡電極從它的特徵來講,主要是為評價熱液連線的電位、測量和校準內置式參比電極的溫度係數實驗用,然而此類型的電極比液體流出型電極處理起來更簡單,比內置式參比電極更穩定且使用壽命長,且具備可修正液體電位的特點,因此在今後的腐蝕研究中將被更廣泛的使用。
電極維護
1、參比電極硫酸銅溶液的配製:把化學純硫酸銅晶體倒入乾淨的玻璃燒杯中,然後倒入適量的蒸餾水(配置用水溫度25℃),用乾淨的玻璃棒(不能用金屬棒)攪拌溶解,並由部分沉積,至此飽和硫酸銅溶液配成。
2、打開參比電極上蓋,把參比電極中的液體倒出,取下各部件。
3、檢查接點連線是否良好,接觸不良處重新連線。清除各部位的表面附著物,特別是銅棒套用砂紙打磨乾淨。檢查半透膜是否完好,發現損壞及時更換,如發現堵塞套用熱水認真浸泡清洗。
4、倒入配置好的飽和硫酸銅溶液,使之淹沒銅棒的三分之二以上,擰緊上蓋,檢查底部半透膜應有溶液滲出,但不能有溶液漏出,否則應更換半透膜。
 氯化銀電極
氯化銀電極 圖1 銀粉的SEM照片
圖1 銀粉的SEM照片 圖2 燒結後電極表面形貌的SEM照片
圖2 燒結後電極表面形貌的SEM照片 表1 Ag/AgCl參比電極在高溫高壓水相體系中的研究
表1 Ag/AgCl參比電極在高溫高壓水相體系中的研究 表2 在高溫和高壓系統中參比電極的優缺點
表2 在高溫和高壓系統中參比電極的優缺點
