基本性質
1、E2反應不需侵入重圍,攻擊之中的碳原子,只需從旁拉走一個質子,因此立體阻礙在此並不如SN2反應般發生影響,因此在一、二、三級受質皆可發生反應,而因為E2反應不會產生碳陽離子,故不會發生重排現象。
2、雙分子消除反應與單分子消除反應和單分子親核取代反應互為競爭反應。但由於E1反應較難發生,所有條件都必須恰到好處,(三級受質、弱鹼、極好的離去基),如果三個條件有一樣稍微不同,反應都較傾向於遵循E2反應機構。
3、E2反應為一步反應,因此應鹼的強弱對其反應速率有很顯著的影響,越強的鹼能使反應進行越快,而對於離去基來說,E2反應需要好的離去基方能進行反,但離去基的影響相較於E1反應並沒有如此敏感,但是離去基越強,皆能增加E1及E2的反應速率。
雙分子消除反應如同SN2反應,反應由一步完成,但不同的是由鹼來拉走質子,而並不是當作親核試劑,鹼進攻β-氫,並與離去基同時離去,生成烯烴。而由於反應為一步完成,與二種反應物濃度皆有關,在反應動力學上是屬於二級反應。
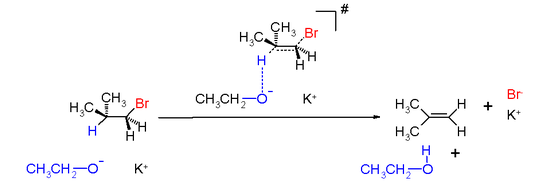
上圖乙醇作為鹼攻擊β-氫,溴帶著共用電子對在離去基作用下離去,而氫以質子的方式離去。
歷史
雙分子消除反應是雙分子反應的一種,雙分子消除反應為19世紀20年代,克里斯托夫·英果爾德(Christopher Kelk Ingold)與羅伯特·魯賓遜((Robert Robinson)展開了一連串有機化學的研究,提出了許多現代有機化學裡的觀念,像是
親核性、親電性、
SN1反應、
SN2反應、E1反應、E2反應等都是在他們研究後先後提出來的嶄新概念,這些概念的提出對揭示有機反應內在機理從而實現控制有機反應起到了巨大的促進作用,而E2反應,就是他們提出越來解釋消除反應的其中一項反應機構。
反應機理
以鹵代烷烴為例
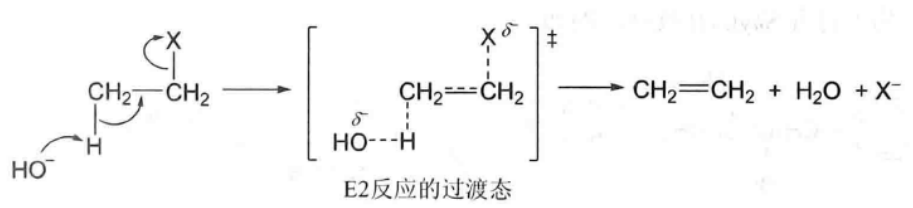
鹵代烷在發生E2反應時,鹼首先進攻β-氫,並逐漸與之結合,β-碳原子與氫原子之間的共價鍵部分斷裂;與此同時,中心碳原子與鹵素之間的共價鍵也部分斷裂,鹵素X帶著一對電子逐漸離開中心碳原子。在此期間電子云也重新分配,α-碳原子與β-碳原子間的π鍵已部分形成,經過如下所示過渡態後,反應繼續進行,最後生成烯烴。反應過程與SN2反應類似,只形成過渡態,沒有中間體生成,反應一步完成,反應速率既與底物鹵代烴的濃度成正比,又與鹼的濃度成正比,所以稱為雙分子消除反應。
鹵代乙烷在KOH作用下的消除反應機理表示如下:
反應活性規律
由此可見,β-C—H鍵和α-C—X鍵越容易斷裂,生成的烯烴越穩定,E2反應越容易進行。反應活性規律總結如下:
1、羥基結構不同的鹵代烷反應活性順序為:R3CX > R2CHX > RCH3X。
這是因為在E2反應過渡態中鍵已部分形成,過渡態具有類烯烴的結構特徵,雙鍵上的取代基越多越穩定,反應所需要克服的活化能越低,反應越容易進行;
2、試劑的鹼性越強,β-C—H鍵越容易斷裂,反應越容易進行;
3、離去基團越容易離去,反應越有利。
對於不同鹵素取代的鹵代烴的反應活性:RI>RBr >RCl。
區域選擇性
仲鹵代烷和叔鹵代烷具有兩種或兩種以上的β-H原子,在發生消除反應時,究竟消去哪一種β-H原子?俄國化學家Saytzeff早在19世紀就從大量實驗結果中歸納總結出鹵代烷消除反應的區域選擇性:主要消除含氫較少的β-碳原子上的氫原子,生成雙鍵碳上取代基較多的烯烴。這一規則稱為Saytzeff規則。
1、反應底物的結構會影響E2反應的區域選擇性。
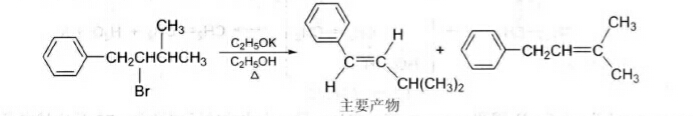
由於共軛多烯烴比一般孤立多烯烴穩定,所以對於消除後可以生成共軛烯烴的底物發生消除反應時,可能得到的主要產物不符合Saytzeff規則。例如,
2、鹼的體積大小也會影響E2反應的區域選擇性。
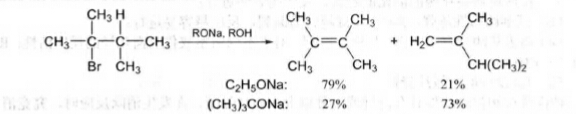
當鹵代烴的β-位空間位阻和鹼的體枳都比較大時,消除反應不利於Saytzeff烯徑的生成,而有利Hofmann烯烴的產生。例如,2,3-二甲基-2-溴丁烷在乙醇鈉或乙醇溶液中發生消除反應時,主要得到Saytzeff烯烴(占79%),但使用大體積的叔丁醇鈉作鹼時,主要得到Hofmamn烯烴(占73%)。
立體化學
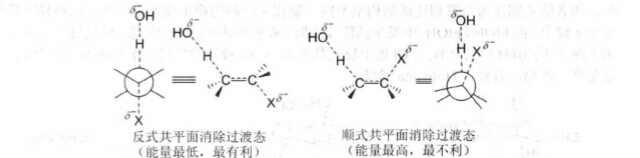
E2消除反應中,在形成過渡態時和C一X鍵已開始變弱,π鍵已部分形成,碳由sp3雜化向sp2雜化轉化。只有H—C—C—X處下同一平面,才可以使過渡態中的部分雙鍵的p軌道達到最大重疊,形成較穩定的過渡態。為了保證H—C一C一X處於同一平面,有兩種構象:一種是交叉式構象,進行反式共平面消除;另一種是重疊式構象,進行順式共平面消除。
一方面,交叉式構象比重疊式穩定。另一方面,在重疊式構象中,鹼只能從離去基團(鹵素)的同側進攻β-H,與離去基團之間存在較大的排斥作用過渡態能量較高。而交叉式構象中,鹼從離去基團的另一側進攻與離去基團間不存在排斥作用,過渡態能量低。所以E2消除反應採用穩定的交叉式構象迸行反式共平面消除,即離去基團與β-H處於反式共平面的位置才能發生E2消除。