基本介紹
- 中文名:考波消除反應
- 外文名:Cope Elimination
定義,實例說明,反應機理,產物特點,相關知識,雙分子消除反應,E2消除反應,E1消除反應,
定義
實例說明
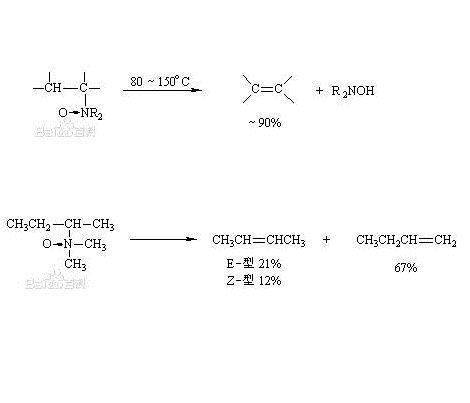
叔胺的N-氧化物(氧化叔胺)熱解時生成烯烴和N,N-二取代羥胺,產率很高,如圖1。
 圖1
圖1實際上只需將叔胺與氧化劑放在一起,不需分離出氧化叔胺即可繼續進行反應,例如在乾燥的二甲亞碸或四氫呋喃中這個反應可在室溫進行。此反應條件溫和、副反應少,反應過程中不發生重排,可用來製備許多烯烴。當氧化叔胺的一個烴基上二個β位有氫原子存在時,消除得到的烯烴是混合物,但是 Hofmann產物為主;如得到的烯烴有順反異構時,一般以 E-型為主。例如(圖2):
 圖2
圖2反應機理
該反應是E2順式消除反應,反應過程中形成一個平面的五元環過度態。氧化叔胺的氧作為進攻的鹼:要產生這樣的環狀結構,氨基和β-氫原子必須處於同一側,並且在形成五元環過渡態時,α,β-碳原子上的原子基團呈重疊型,這樣的過度態需要較高的活化能,形成後也很不穩定,易於進行消除反應。
 圖3 反應機理
圖3 反應機理產物特點
當氧化胺的一個烴基的兩個β-碳上均有氫原子可以消除時,得到的是混合物,但以Hofmann產物為主。當氧化胺上有兩個或三個烴基均有β-氫時,得到混合物。得到的烯烴如有順反異構,則一般以反式異構體為主。三級胺被過氧化氫或過酸的氧化和氧化胺的消除可以在同一體系中完成,如在二甲基亞碸或四氫呋喃溶劑中室溫就可反應。反應條件溫和,副反應少,反應中無重排反應發生,得到的不是重排後的烯烴,因此可用於製備很多烯烴。
相關知識
雙分子消除反應
為19世紀20年代,克里斯托夫·英果爾德(Christopher Kelk Ingold)與羅伯特·魯賓遜(Robert Robinson)展開了一連串有機化學的研究,提出了許多現代有機化學裡的觀念,像是親核性、親電性、SN1反應、SN2反應、E1反應、E2反應等都是在他們研究後先後提出來的嶄新概念,這些概念的提出對揭示有機反應內在機理從而實現控制有機反應起到了巨大的促進作用,而E2反應,就是他們提出越來解釋消除反應的其中一項反應機制。
E2消除反應
又名雙分子消除反應,雙分子消除反應是雙分子反應的一種。
特點:
1、E2反應不需侵入重圍,攻擊之中的碳原子,只需從旁拉走一個質子,因此立體阻礙在此並不如SN2反應般發生影響,因此在一、二、三級受質皆可發生反應,而因為E2反應不會產生碳陽離子,故不會發生重排現象。
2、雙分子消除反應與單分子消除反應和單分子親核取代反應互為競爭反應。但由於E1反應較難發生,所有條件都必須恰到好處,(三級受質、弱鹼、極好的離去基),如果三個條件有一樣稍微不同,反應都較傾向於遵循E2反應機構。
3、E2反應為一步反應,因此應鹼的強弱對其反應速率有很顯著的影響,越強的鹼能使反應進行越快,而對於離去基來說,E2反應需要好的離去基方能進行反,但離去基的影響相較於E1反應並沒有如此敏感,但是離去基越強,皆能增加E1及E2的反應速率。
雙分子消除反應如同SN2反應,反應由一步完成,但不同的是由鹼來拉走質子,而並不是當作親核試劑,鹼進攻β-氫,並與離去基同時離去,生成烯烴。而由於反應為一步完成,與二種反應物濃度皆有關,在反應動力學上是屬於二級反應。
E1消除反應
又名單分子消除反應。反應物先電離,離去基團斷裂下來,同時生成一個碳正離子,然後失去β氫原子並生成π 鍵。反應分兩步進行,決定速率這一步(決速步)只有反應物分子參加。故E1的速率與反應物的濃度成正比,與鹼的濃度無關。單分子消除反應,而1代表反應速率只受其中一個化合物濃度的影響),由於反應的速率控制步驟只與一個底物分子有關,是單分子過程,在反應動力學上是一級反應,故稱為“單分子消除反應”。
由於中間體碳正離子會發生重排,故E1反應會得到重排產物。E1反應的區域選擇性與E2反應相同,反應物有兩種不同的β-氫時,反應遵循查依采夫規則,主要生成穩定的烯烴。產物烯烴有順反異構時,以E型烯烴為主。
單分子消除反應與雙分子消除反應和單分子親核取代反應為競爭反應。當鹵代烴在鹼作用下消除時,由於C-X鍵遠不如C-H鍵容易斷裂,因而消除反應一般都採取E2機理。只有三級鹵代烴在極性溶劑中溶劑解或醇失水時,反應才為E1機理。與SN1機理相對比,E1反應和SN1反應第一步都為鹵代烴的異裂,故離去基團的離去難易程度並不影響這兩種機理的競爭,只有第二步中親核試劑與碳正離子的結合方式決定了這兩種機理的比例。試劑親核性越強,空間位阻越小,對SN1機理越有利。因此在極性溶劑和無強鹼存在時,取代產物是主要產物。