基本介紹
- 中文名:鑭系元素
- 外文名:lanthanide element
- 特點:銀白色或灰色光澤等
- 化學性質:比較活潑
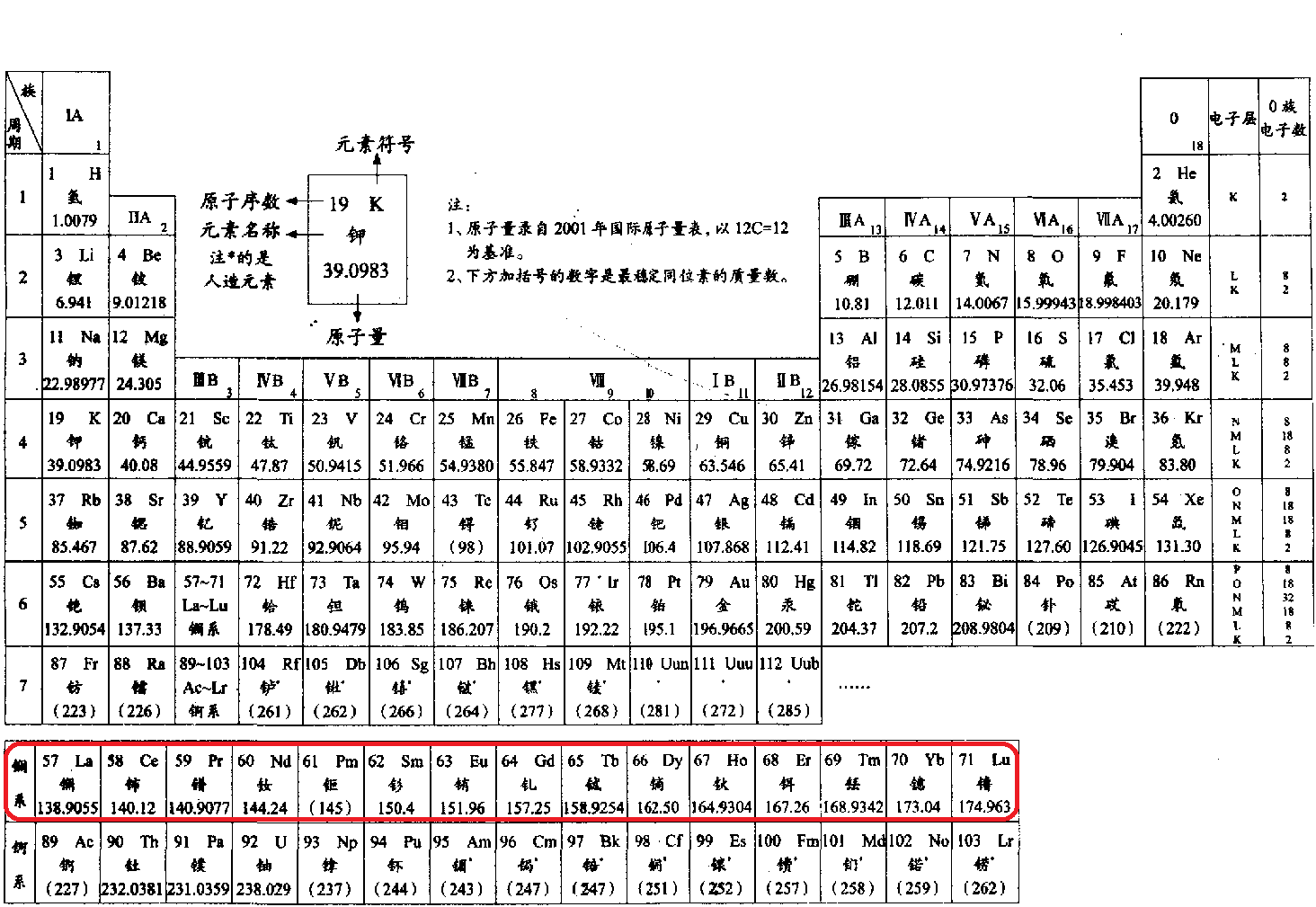
鑭系元素(別名稀土元素 Rare Earths,用RE 表示)是指元素周期表中第57號元素鑭到71號元素鑥15種元素的統稱。它們的化學性質相似,單獨組成一個系列,在元素周期表中...
鑭系元素(lanthanide element)是元素周期系ⅢB族中原子序數為57~71的15種化學元素的統稱。由於鑭系元素都是金屬,所以又稱鑭系金屬。鑭系金屬具有銀白色或灰色光澤,...
鑭是一種金屬稀土元素,原子序數57,原子量138.9055,元素名來源於希臘文,原意是“隱蔽”。銀灰色光澤,質地較軟,密度6.174g/cm³,熔點921℃,沸點3457℃;化學性質...
過渡金屬元素(transition metals)是指元素周期表中d區與ds區(d區元素包括周期系第ⅢB~ⅦB,ⅦI族的元素。不包括鑭系和錒系元素。ds區包括周期表第ⅠB~ⅡB族...
鋱是鑭系元素中的一員,原子序數65。銀白色金屬,元素符號Tb,屬稀土金屬,無色結晶的粉末,有毒。它的化合物可做殺蟲劑,亦用來治療皮膚病。鋱的貴重性和其具有的...
鑥為銀白色金屬,是稀土元素中最硬和最緻密的金屬;熔點1663℃,沸點3395℃,密度9.8404。鑥在空氣中比較穩定;氧化鑥為無色晶體,溶於酸生成相應的無色鹽。鑥主要...
金屬-有機框架(Metal-Organic Frameworks),簡稱MOFs,是由有機配體和金屬離子或團簇通過配位鍵自組裝形成的具有分子內孔隙的有機-無機雜化材料。...
金屬是一種具有光澤(即對可見光強烈反射)、富有延展性、容易導電、導熱等性質的物質。 地球上的絕大多數金屬元素是以化合態存在於自然界中的。這是因為多數金屬的...
有色金屬[Metallurgy]non-ferrous metal,狹義的有色金屬又稱非鐵金屬,是鐵、錳、鉻以外的所有金屬的統稱。廣義的有色金屬還包括有色合金。有色合金是以一種有...
鐦(英語:Californium)是一种放射性金屬元素,符號為Cf,原子序為98。鐦屬於錒系元素,是第六個被人工合成出來的超鈾元素,自然界能自行產生的元素中質量最高的,所有...
錒是一种放射性金屬。元素符號Ac,原子序數89,元素的相對原子質量227.0278,屬錒系元素。已發現錒有質量數從209到233的25種同位素。除227Ac和228Ac是天然放射性...
顏色中的元素易爆元素銀金家中的元素燈光所涉及的元素有毒的元素!鋁矽硫水銀氯元素設計師名字里包含了什麼?鹼金屬和鹼土金屬鑭系金屬和錒系金屬...
金屬礦物是指具有明顯的金屬性的礦物。如呈金屬或半金屬光澤,具各種金屬色(如鉛灰、鐵黑、金黃等),不透明,不導電,導熱性良好的礦物。它們絕大多數是重金屬元素...
鐨為人造放射性元素,元素符號為Fm, 金屬元素,化學性質類似稀土元素。1952年,美國加州大學伯克利分校教授吉奧索帶領團隊首次發現鐨,而後為了紀念物理學家費米將此元素...
鍆是一個人工合成元素,符號為Md(曾為Mv),原子序為101。鍆是錒系元素中具有放射性的超鈾金屬元素,通常的合成方式是以α衰變撞擊鑀元素。鍆(Mendelevium)以最先...
鑭系氧化物超導陶瓷是一種含鑭的銅基氧化物超導陶瓷。化學式為La2MxCuO4..(M=Sr、Ba、Ca等)。晶體結構與K2NiF4相同,隨摻雜量x的增加,晶體結構由正交變為...
銪是一種金屬元素,銀白色,能燃燒成氧化物;氧化物近似白色。銪為鐵灰色金屬,熔點822°C,沸點1597°C,密度5.2434克/厘米3;是稀土元素中密度最小、最軟和最易...
稀土金屬(rare earth metals)又稱稀土元素,是元素周期表ⅢB族中鈧、釔、鑭系17種元素的總稱,常用R或RE表示。從1794年發現第一個稀土元素釔,到1972年發現自然界...
