以金屬氧化物為主要催化活性組分的催化劑。
金屬氧化物:在日常生活中套用廣泛。
基本介紹
- 中文名:金屬氧化物催化作用
- 類別:作用
- 類型:催化
- 對象:金屬氧化物
以金屬氧化物為主要催化活性組分的催化劑。
金屬氧化物:在日常生活中套用廣泛。

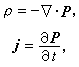
以金屬氧化物為主要催化活性組分的催化劑。金屬氧化物:在日常生活中套用廣泛。...... 氧化物催化劑和主族金屬氧化物催化劑,後者主要為固體酸鹼催化劑(見酸鹼催化...
金屬氧化物是指氧元素與另外一種金屬化學元素組成的二元化合物,如氧化鐵(Fe₂O₃)、氧化鈉(Na₂O)等。...
以金屬氧化物為主要催化活性組分的催化劑。...... 在金屬氧化物催化的氧化反應中有多種活化的過渡態氧生成,如O娛、O、O,它們表現出不同的反應活性,可分兩種作...
氧化物催化劑即具有催化作用的氧化物。多為金屬氧化物,常為粉末狀或多孔體,通常指金屬氧化物特別是過渡金屬氧化物為主活性組分的多相催化劑。例如,氧化鋁可催化...
▪ 作用方式 ▪ 性能指標 4 催化種類 ▪ 均相催化 ▪ 多相催化 ▪ 復相催化 ▪ 生物催化 ▪ 金屬催化 ▪ 金屬氧化物催化 ▪ ...
金屬-載體強相互作用的成因是金屬與載體低價金屬離子之間成鍵、金屬與載體之間電子遷移和金屬與載體之間的相互擴散。金屬-載體強相互作用影響催化劑對氫氣、一氧化碳...
催化作用,催化劑在化學反應中所起的作用。在催化反應中,催化劑與反應物發生化學作用,改變了反應途徑,從而降低了反應的活化能。由於催化劑的介入而加速或減緩化學...
在催化劑作用下進行的化學反應稱為催化反應。化學反應中,反應分子原有的某些化學...通常所說的催化劑是指正催化劑。常用的催化劑主要有金屬、金屬氧化物和無機酸...
1950年前蘇聯沃爾肯斯坦提出,把催化作用描述為反應分子與催化劑表面之間的一種電子傳遞過程,擔負此傳遞任務的是用作催化劑的半導體(過渡金屬氧化物)的導帶中的自由電...
金屬氧化物催化劑、均相催化劑及催化作用,環境催化、生物催化、光催化的催化作用基礎及套用;第11章介紹了催化劑的常用製備方法及成型;第12章介紹了催化劑的性能...
半導體氧化物催化劑sfmicnnductingoxidecatalyst過渡金屬氧化物通常是半導體,用它製成的催化劑稱為半導體氧化物催化劑。...
在這種情況下,固體表面起著一種促進某個化學反應的催化劑的作用。[2] ...應該分別介於最強和最弱的金屬氧化物,氫化物和氮化物鍵能的數值之間;氧化鉑和...
脫氫反應受熱力學限制需在高溫下進行,應使用能耐高溫催化劑,一般採用金屬氧化物...苯乙烯,無色液體,難溶於水,用途很廣,主要用於生產樹脂、塑膠和橡膠。烴類裂解...
對於沸石分子篩型裂解催化劑,分子篩的孔結構、酸性及晶粒大小是影響催化作用的三個最重要因素;而對於金屬氧化物型裂解催化劑,催化劑的活性組分、載體和助劑是影響...
薄膜型金屬氧化物超細催化劑179其他結構型金屬氧化物催化劑183納米微孔結構分子篩191分子篩結構簡介191分子篩的結構與性能194分子篩催化作用202...
也有一種說法,催化劑參與化學反應。在一個總的化學反應中,催化劑的作用是降低...多相催化劑有固體酸催化劑、有機鹼催化劑、金屬催化劑、金屬氧化物催化劑、...
常見的光催化劑多為金屬氧化物和硫化物,如Tio2, ZnO,CdS,WO3等,其中Tio2的...而我們的光催化反應則將這個反應反過來了,即催化劑在光的作用下,將有機物轉化...
加氫催化劑,指化合物與氫加成時使用的催化劑,常用的有第Ⅷ族過渡金屬元素的金屬催化劑,金屬氧化物或硫化物催化劑,絡合催化劑,一般為氧化鋁載體。...
電催化是使電極、電解質界面上的電荷轉移加速反應的一種催化作用。電極催化劑的範圍僅限於金屬和半導體等的電性材料。電催化研究較多的有骨架鎳、硼化鎳、碳化鎢...
