金屬催化劑是一類重要的工業催化劑。主要包括塊狀催化劑,如電解銀催化劑、融鐵催化劑、鉑網催化劑等;分散或者負載型的金屬催化劑。
基本介紹
- 中文名:金屬催化作用
- 類型:工業催化劑
- 包括:塊狀催化劑
- 例如:過渡金屬
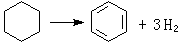
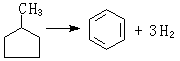
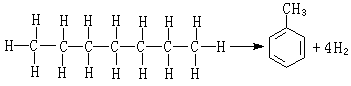
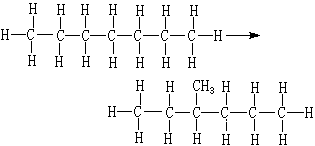
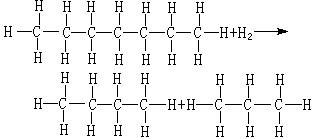
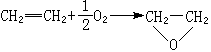
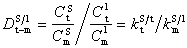
金屬催化劑是一類重要的工業催化劑。主要包括塊狀催化劑,如電解銀催化劑、融鐵催化劑、鉑網催化劑等;分散或者負載型的金屬催化劑。
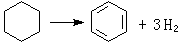




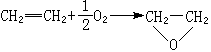
金屬催化劑是一類重要的工業催化劑。主要包括塊狀催化劑,如電解銀催化劑、融鐵催化劑、鉑網催化劑等;分散或者負載型的金屬催化劑。...
催化改變化學反應速率而不影響化學平衡的作用。催化劑改變化學反應速率的作用稱催化作用,它本質上是一種化學作用。在催化劑參與下進行的化學反應稱催化反應。催化是...
催化作用,催化劑在化學反應中所起的作用。在催化反應中,催化劑與反應物發生化學作用,改變了反應途徑,從而降低了反應的活化能。由於催化劑的介入而加速或減緩化學...
以金屬氧化物為主要催化活性組分的催化劑。金屬氧化物:在日常生活中套用廣泛。...... 氧化物催化劑和主族金屬氧化物催化劑,後者主要為固體酸鹼催化劑(見酸鹼催化...
貴金屬催化劑(precious metal catalyst)一種能改變化學反應速度而本身又不參與反應最終產物的貴金屬材料。幾乎所有的貴金屬都可用作催化劑,但常用的是鉑、鈀、銠、...
配位催化作用是在催化劑活性中心的配位界內進行的催化作用,或在總反應的每一個基元步驟中,至少有一個反應物是配位的催化作用。配位催化作用的催化劑絕大多數是...
電催化是使電極、電解質界面上的電荷轉移加速反應的一種催化作用。電極催化劑的範圍僅限於金屬和半導體等的電性材料。電催化研究較多的有骨架鎳、硼化鎳、碳化鎢...
三元催化,是指將汽車尾氣排出的CO、HC和NOx等有害氣體通過氧化和還原作用轉變為無害的二氧化碳、水和氮氣的催化。主要是用三元催化器, 三元催化器的載體部件是一...
以金屬為主要活性組分的固體催化劑。主要是貴金屬及鐵、鈷、鎳等過渡元素。有單金屬和多金屬催化劑。...
三元催化器,是安裝在汽車排氣系統中最重要的機外淨化裝置,它可將汽車尾氣排出的CO、HC和NOx等有害氣體通過氧化和還原作用轉變為無害的二氧化碳、水和氮氣。當高溫...
《金屬催化反應(第5卷)》根據“經典性與新穎性並存”的原則,精選了10種金屬催化的有機反應。對於每一種反應,詳細介紹了其歷史背景、反應機理、套用範圍和限制,...
《催化劑基礎及套用》全書包括13章,第1~3章分別介紹了催化劑與催化作用的基礎知識,吸附作用與多相催化;第4~10章分別介紹了酸鹼催化劑、金屬催化劑、金屬氧化物...
催化石墨化(catalytic graphitization)是指在配料中添加某種具有催化作用的物質,促使焙燒品在較低的溫度下石墨化或在相同的溫度下提高石墨化程度。催化劑金屬或合金...
過渡金屬催化劑(transition metal catalyst),屬催化劑,性質為過渡金屬絡合物。...... 過渡金屬催化劑(transition metal catalyst),屬催化劑,性質為過渡金屬絡合物。...
雙金屬催化劑往往稱為合金催化劑。...... 合金催化劑一般由活潑金屬與惰性金屬組成,它能夠顯示一種金屬被另一種金屬稀釋的幾何或集團效應,以及電子相互影響的“配位...
電催化是使電極、電解質界面上的電荷轉移加速反應的一種催化作用。電極催化劑的範圍僅限於金屬和半導體等的電性材料。電催化研究較多的有骨架鎳、硼化鎳、碳化鎢...
有機金屬化合物在生產和生活中用途廣泛。例如,在製備高分子化合物時,常用烷基鋁作催化劑;在有機合成中,有機金屬化合物可提供碳負離子、自由基和卡賓等活潑中間體...
納米金屬金(Au) 編輯 具有高電子密度、介電特性和催化作用,能與多種生物大分子結合,且不影響其生物活性。納米金屬銀(Ag) 編輯 ...
後過渡金屬催化劑是指以鎳( Ⅱ) 、鈀( Ⅱ) 、鐵( Ⅱ) 、鈷( Ⅱ) 、釕( Ⅱ)等後過渡金屬原子為活性中心的一類金屬配合物烯烴聚合催化劑。...
各種元素髮生相互作用而形成一種具有金屬特性的物質稱為金屬化合物。金屬化合物的...原子簇金屬化合物具有選擇催化和活化小分子的性能,例如,某些烴基次甲基九羰基三...
薄膜型金屬氧化物超細催化劑179其他結構型金屬氧化物催化劑183納米微孔結構分子篩191分子篩結構簡介191分子篩的結構與性能194分子篩催化作用202...
