基本介紹
- 中文名:化學反應速率方程
- 外文名:the rate law or rate equation for a chemical reaction
- 性質:科學
- 類別:化學
- 解釋:質量作用定律的表達式
簡介
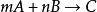





質量作用定律
反應速率方程的定義
速率方程的確定
- 微分法:對 求對數,得到:
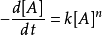
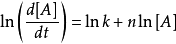
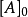


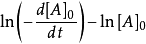
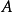


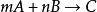


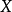


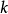

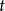
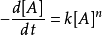
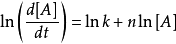
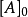


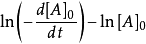
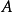


化學反應速率方程是利用反應物濃度或分壓計算化學反應的反應速率的方程。而化學反應速率通常指的是單位時間內反應物濃度的減少或生成物濃度的增加。根據時間的長短,...
反應速率方程 r=k【A】^a【B】^b,此比例係數k,是一個與濃度無關的量,稱為速率常數(rate constant),也稱為速率係數。...
反應動力學是研究各種物理、化學因素(如溫度、壓力、濃度、反應體系中的介質、催化劑、流場和溫場分布、停留時間分布等)對反應速率的影響以及相應的反應機理和數學...
高中化學(化學實驗化學計算)/專題突破化學反應速率與化學平衡(高中版)/魔法化學專題突破05秋龍門專題 化學基本概念和原理 國中化學國中數學方程(1最新修訂)/龍門專題...
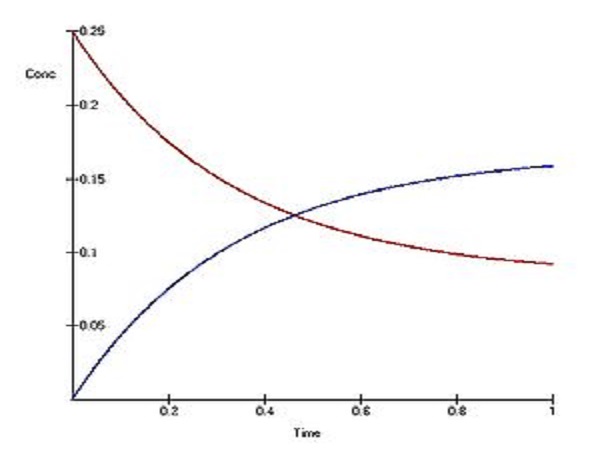
一級動力學反應是反應化學反應速率與參與反應或與反應有關的物質的條件(濃度)的關係的動力學方程。常用形式為C = C0 exp (-k1t)。...
《化學反應動力學》是2005年1月化學工業出版社出版的圖書,作者是許越。...... 一.反應體系二.化學計量方程三.化學反應的動力學分類四.化學反應速率五.反應速率方...
溫度與反應速度的關係實際上是溫度與反應速度常數的關係 ,阿侖尼烏斯 (Arrhenius...阿侖尼烏斯方程人物簡介 編輯 阿侖尼烏斯是瑞典傑出的物理化學家,電離學說的創立...
阿累尼烏斯方程又稱為阿倫尼烏斯方程,是化學動力學的重要公式,由瑞典的阿倫尼烏斯所創立的化學反應速率常數隨溫度變化關係的經驗公式。該公式具有三種不同的表達式,即:...
反應級數:在化學反應的速率方程中,各反應物的濃度項的指數之和稱該反應的反應級數。反應級數與化學計量數的關係:對於基元反應反應物的分級數與該反應物的化學計量...
化學反應速率是用來衡量化學反應進行快慢程度的。通常是用單位時間內反應物濃度的減少或生成物濃度的增加來表示。...
非活化分子轉變為活化分子所需吸收的能量為活化能的計算可用阿倫尼烏斯方程求解。阿倫尼烏斯方程反應了化學反應速率常數K隨溫度變化的關係。在多數情況下,其定量規律可...
