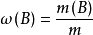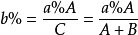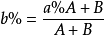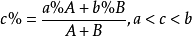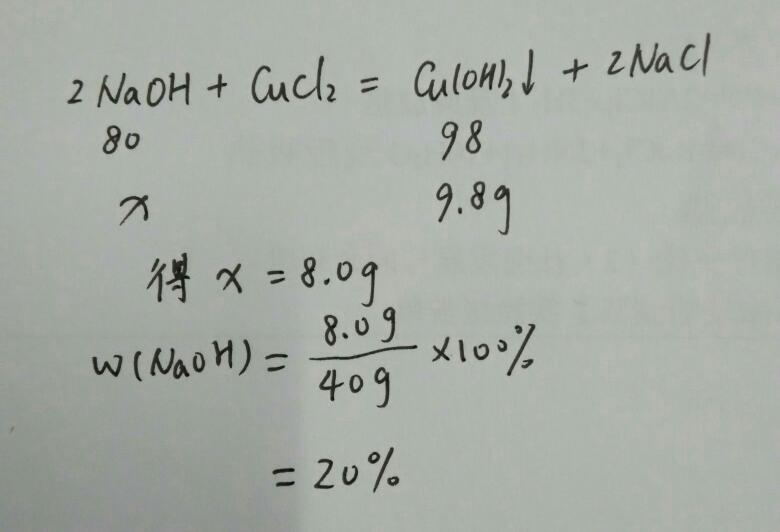定義
定義一
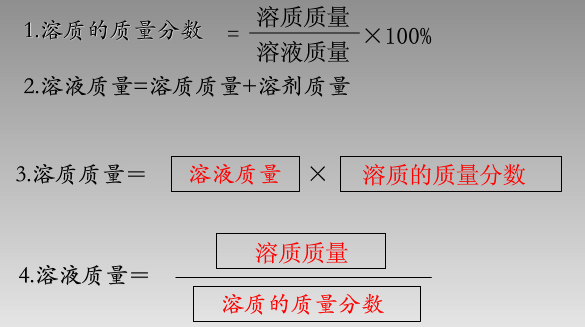
質量分數(mass fraction)是指溶質質量與溶液質量的百分比(溶質B的質量占溶液質量的分數)或。用符號ω表示。
上式中ω(B)的量綱為1,也可用百分數表示。
定義二
質量分數也可以指化合物中各原子相對原子質量(需乘係數)與總式量的比值,即某元素在某物質中所占比例。例如物質Fe
2O
3(
氧化鐵),則Fe的質量分數為:56*2/160*100%=70%元素的質量分數用途廣泛,其中在食品包裝上的“營養成分”標示等都要用到元素的質量分數。
概念辨析
溶解度和飽和
溶解度是用來表示一定溫度下,某物質在某溶劑中溶解性的大小。溶質的質量分數用來表示溶液組成
濃溶液中溶質的質量分數大,但不一定是飽和溶液,稀溶液中溶質的質量分數小,但不一定是不飽和溶液。
飽和溶液的質量分數的計算:

注意事項
溶質的質量分數隻表示溶質質量與溶液質量之比,並不代表具體的溶液質量和溶質質量。
溶質的質量分數計算式中溶質質量與溶液質量的單位必須統一。
若溶質全部溶於水,且不與水發生
化學反應,直接利用計算公式進行計算。計算式中溶質質量是指被溶解的那部分溶質的質量,沒有被溶解的那部分溶質質量不能計算在內。
若溶質為
結晶水合物,溶於水後,其溶質的質量就不包括結晶水的質量。因為結晶水合物溶於水時,結晶水就轉化為溶液中的溶劑,且水的質量有增加。
關於酸、鹼、
鹽溶液間發生1~2個化學反應,求反應後所得溶液——溶質質量分數問題的計算。首先要明確生成的溶液中溶質是什麼,其次再通過化學反應計算溶質質量是多少,(往往溶質質量由幾個部分組成)最後分析各量間關係求出溶液總質量,再運用公式計算出反應後溶液中溶質的質量分數。
a溶液組成法
溶液質量=溶質質量+溶劑質量,其中溶質一定是溶解的,溶劑水根據不同的題目通常有兩種情況:①原溶液中的水,②化學反應新生成的水。
b、質量守恆法
溶液質量=m(反應)-m↓-m↑,此法較為簡單,其m(反應)代表
反應物(或溶液)質量總和,m↓表示不溶固體及生成沉澱的質量,m↑表示生成氣體的質量。
稀釋增濃
稀釋
⑴加水
稀釋:因為溶液稀釋前後,溶質的質量不變,所以若設濃溶液質量為A克,溶質的質量分數為a%,加B克水稀釋成溶質的質量分數為b%的稀溶液C克。計算公式
⑵加稀溶液稀釋
因為混合後的溶液的總質量等於兩混合組分溶液的質量之和,混合後的溶液中溶質質量等於兩混合組分的溶質質量之和。所以,設原溶液質量為 A g,溶質的質量分數為a%,稀溶液質量為B g,溶質的質量分數為b%,兩溶液混合後得到溶質的質量分數為c%的溶液,則:
增濃
⑴加溶質
溶液增加溶質前後,溶劑的質量不變。增加溶質後,溶液中溶質的質量=原溶液中溶質的質量+增加的溶質的質量,而溶液的質量=原溶液的質量+增加的溶質的質量。
所以,若設原溶液質量為A g,溶質的質量分數為a%,加溶質Bg後變成溶質的質量分數為b%的溶液。
⑵蒸發
因為溶液蒸發溶劑前後,溶質的質量不變。所以,若設原溶液質量為A g,溶質的質量分數為a%,蒸發Bg水後變成溶質的質量分數為b%的溶液,則:Ag×a%=(Ag-Bg)×b%。
(3)與濃溶液混合
因為混合後的溶液的總質量等於兩混合組分溶液的質量之和,混合後的溶液中溶質質量等於兩混合組分的溶質質量之和。所以,設原溶液質量為 A g,溶質的質量分數為a%,濃溶液質量為B g,溶質的質量分數為b%,兩溶液混合後得到溶質的質量分數為c%的溶液,則:
濃度換算
C*M=1000*ρ*ω 即物質的量濃度乘以
摩爾質量等於1000乘以密度乘以質量分數。
c= (V·ρ·ω/M)/V= V·ρ·ω/MV=1000ρ·ω/M
ω=cM/1000ρ