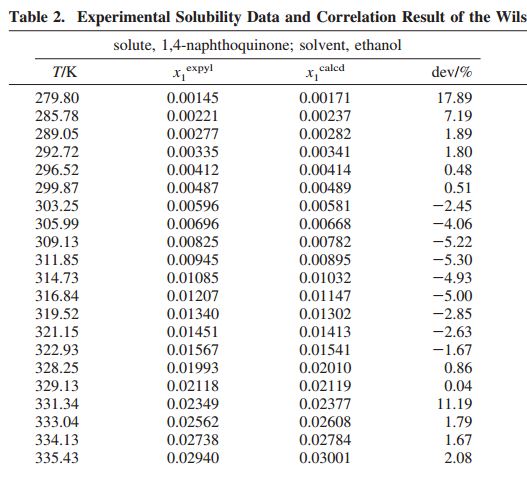
混合物中溶質B的物質的量與混合物各組分物質的量之和的比值,稱為摩爾分數(mole fraction),用符號xB表示。
xB=nB/n
式中:xB表示溶質B的摩爾分數,單位為1;nB表示溶質B的物質的量,單位為mol;n為混合物的物質的量,單位為mol。
顯然,溶液中各組分摩爾分數之和等於1,即∑xi=1。
基本介紹
- 中文名:摩爾分數
- 外文名:mole fraction
- 套用學科:無機化學
- 量綱:1
- 符號:X
- 相關量:物質的量
- 舊名:克分子分數
定義
 圖二
圖二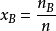
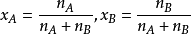
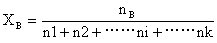 圖一
圖一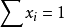
濃度換算

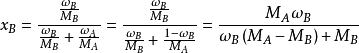
影響因素
示例
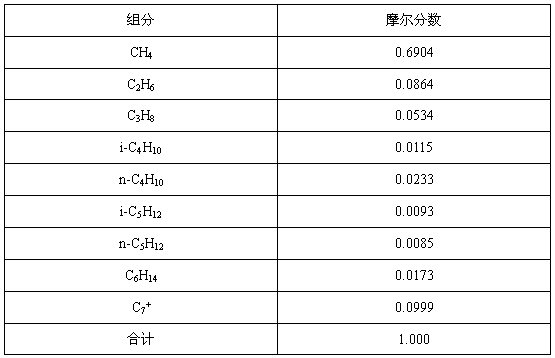 某有機混合各物質的摩爾分數
某有機混合各物質的摩爾分數