物質的量濃度計算公式是一個用來計算物質的量濃度的公式。公式內容為:溶質的物質的量=溶質的物質的量濃度x溶液的體積n=c·v。該公式也叫摩爾定律。
基本介紹
- 中文名:物質的量濃度計算公式
- 外文名:molar concentration
- 別稱:摩爾定律
- 表達式:n=c·v
- 提出者:摩爾
- 套用學科:化學
- 適用領域範圍:化學計算
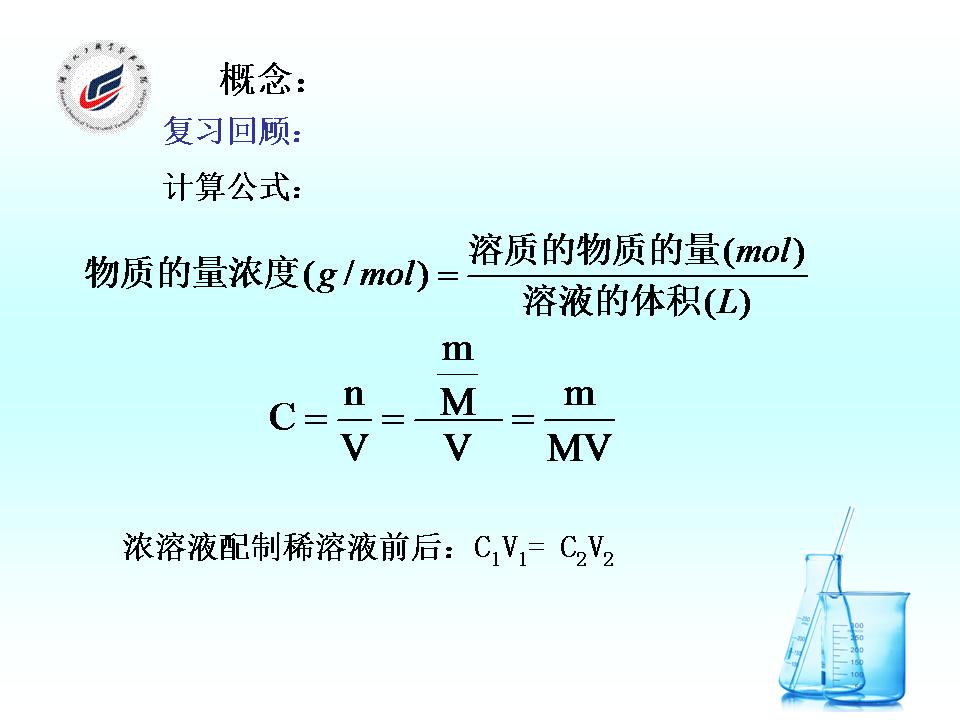
物質的量濃度計算公式是一個用來計算物質的量濃度的公式。公式內容為:溶質的物質的量=溶質的物質的量濃度x溶液的體積n=c·v。該公式也叫摩爾定律。
物質的量濃度計算公式是一個用來計算物質的量濃度的公式。公式內容為:溶質的物質的量=溶質的物質的量濃度x溶液的體積n=c·v。該公式也叫摩爾定律。...
濃度是溶液中溶劑和溶質的相對含量。物質的量濃度是一種常用的溶液濃度的表示方法。...
是分析化學中的一個名詞。含義是以1升溶液中所含溶質的摩爾數表示的濃度。以單位體積里所含溶質的物質的量(摩爾數)來表示溶液組成的物理量,叫作該溶質的摩爾...
摩爾套用於計算微粒的數量、物質的質量、氣體的體積、溶液的濃度、反應過程的熱量變化等。 摩爾來源於拉丁文moles,原意為大量、堆積。1971年第十四屆國際計量大會關於...
質量分數公式是計算質量分數的公式,質量分數是指某物質中某種成分的質量與該樣品中總物質質量之比的百分數。如在溶液中溶質質量與溶液質量之比的溶質質量分數;在混合...
溶液中某溶質的物質的量除以溶劑的質量,稱為該溶質的質量摩爾濃度,單位為mol/kg。質量摩爾濃度與物質的量濃度相比,前者不隨溫度變化,在要求精確濃度時,必須用質量...
化學計量方法編輯 鎖定 有關化學組成、化學變化中,量和能量的關係及其計算。其...全部反應完畢後,共收集到氣體2.24升(S.T.P),則該硝酸溶液的物質的量濃度...
滴定度是指每1mL某摩爾濃度的滴定液(標準溶液)所相當的被測藥物的質量(g/mL...滴定度計算公式 編輯 滴定度TB/A每毫升標準溶液相當於被測物質的質量 單位是g...
最後分析各量間關係求出溶液總質量,再運用公式計算出反應後溶液中溶質的質量分數...質量分數與物質的量濃度之間的關係:C*M=1000*ρ*ω 即物質的量濃度乘以摩爾...
c:濃度n:物質的量v:溶液體積配製溶液計算公式 編輯 一、用液體試劑配製:根據稀釋前後溶質質量相等原理得公式:ω1ρ1 V1= ω2ρ2 V2ω1:稀釋質量分數ρ1 :...
通常以Ca2+、Mg2+含量計算,單位有兩種,一種用毫克當量/升表示,一種用度表示...下面把“度’’單位換成物質的量濃度的方式表示。根據公式: c=n/v,M=m/n...
mol/L是一個濃度單位,例如 a mol/L就是1L溶液中所含某種物質的物質的量是a mol。M作為單位在以前用來表示mol/L,例如1M NaOH溶液即為1mol/L NaOH溶液。但...
V為溶液的體積,c為溶液的濃度,R為氣體常數,n為溶質的物質的量,T為絕對溫度...通過測定溶液的滲透壓,可以計算溶質的相對分子質量。如果溶質的質量為m,摩爾質量...
1 質量分數 2 相關概念 ▪ 與溶質質量 ▪ 溶液稀釋計算 ▪ 溶液增濃計算 ▪ 與物質的量濃度 ▪ 轉化公式 ▪ 溶質的質量分數 元素...
3、溶質濃度用物質的量濃度表示的化學勢形式活度和活度因子求法1、蒸汽壓法...總之,活度套用於冶金過程,使得冶金反應能定量地進行熱力學計算和分析,在闡明多種...
V為溶液的體積,c為溶液的濃度,R為氣體常數,n為溶質的物質的量,T為絕對溫度...通過測定溶液的滲透壓,可以計算溶質的相對分子質量。如果溶質的質量為m,摩爾質量...
