親電取代反應(electrophilic substitution reaction)是指化合物分子中的原子或原子團被親電試劑取代的反應。最重要的親電取代反應是苯環上的親電取代反應一一芳香親電取代反應。
基本介紹
- 中文名:親電取代反應
- 外文名:electrophilic substitution reaction
反應歷程
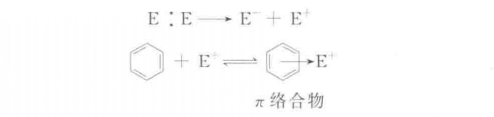
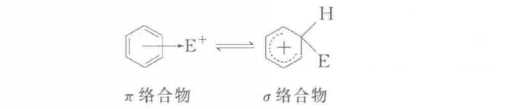
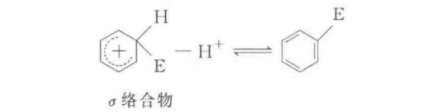
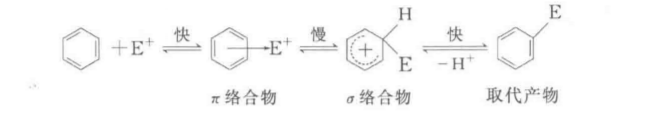
主要反應
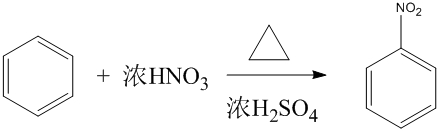 硝化反應
硝化反應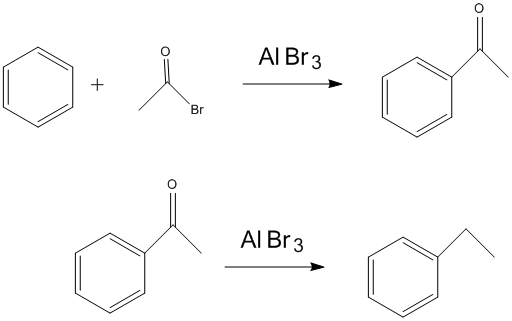 醯基化及還原
醯基化及還原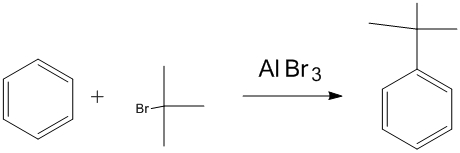 烷基化反應
烷基化反應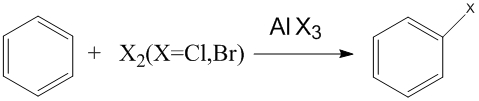 鹵化反應
鹵化反應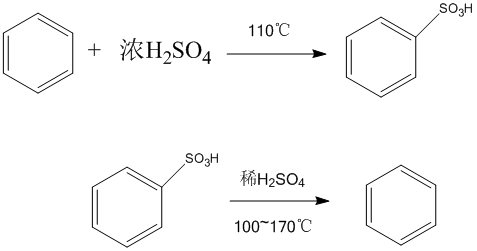 磺化反應
磺化反應親電取代一般指本詞條
親電取代反應(electrophilic substitution reaction)是指化合物分子中的原子或原子團被親電試劑取代的反應。最重要的親電取代反應是苯環上的親電取代反應一一芳香親電取代反應。


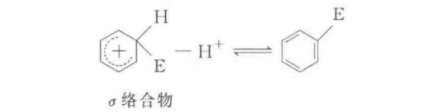

 硝化反應
硝化反應 醯基化及還原
醯基化及還原 烷基化反應
烷基化反應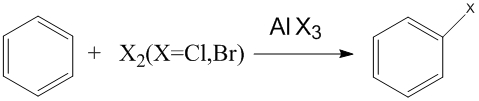 鹵化反應
鹵化反應 磺化反應
磺化反應親電取代反應(electrophilic substitution reaction)是指化合物分子中的原子或原子團被親電試劑取代的反應。最重要的親電取代反應是苯環上的親電取代反應一一芳香親電...
親電取代反應也可分為兩種機制,即單分子親電取代SE1和雙分子親電取代SE2,這與脂肪親核取代反應可分為SN1和SN2是類似的。...
親電取代反應也可分為兩種機制,即單分子親電取代SE1和雙分子親電取代SE2,這與脂肪親核取代反應可分為SN1和SN2是類似的。SE1反應是分步進行的,反應物首先離解成...
親電取代反應一種親電試劑取代其它官能團的化學反應,這種被取代的基團通常是氫,但其他基團被取代的情形也是存在的。親電取代是芳香族化合物的特性之一,因此一般稱...
取代反應可分為親核取代、親電取代和均裂取代三類。如果取代反應發生在分子內各基團之間,稱為分子內取代。有些取代反應中又同時發生分子重排(見重排反應)。 需要...
取代是指有機分子裡的某些原子或原子團通過化學反應被其他原子或原子團所替代。包括親核取代和親電取代。...
由單環芳烴的親電取代反應可以看出,當芳環上已有取代基時,新引入基團是否容易,進入哪個位置,主要由芳環原來取代基的性質所決定。我們把芳環上原來具有的取代基...
橋頭取代是指橋環化合物中,發生在橋頭原子上的取代反應。和其它取代反應一樣,有親核取代、親電取代和自由基取代三種類型。其中親核取代有 SN1 和 SN2 兩種,但是...
親電性,指某物質具有從其他分子或離子獲得電子或與其他分子或離子分享電子的性質。有親電試劑參與的反應,均為親電子反應,如親電子催化反應,即催化劑從反應物取得...
芳香烴的親電取代編輯 鎖定 本詞條缺少信息欄、名片圖,補充相關內容使詞條更完整,還能快速升級,趕緊來編輯吧!這種類型中最重要的反應包括芳香環系的硝化反應,鹵...
反應物分子中的一個基團被另一基團所取代的反應,稱為取代反應。其中與親核試劑作用者稱為親核取代反應;與親電試劑作用者稱為親電取代反應。SN1表示單分子(或一...
親電反應指缺電子(對電子有親和力)的試劑進攻另一化合物電子云密度較高(富電子)區域引起的反應。親電反應屬於離子型反應(ionic reaction)的一種,是有機化學的...
移位芳香親核取代反應,芳香族化合物的親核取代反應(SNAr)是重要的有機反應,得到廣泛的套用。 SNAr 反應作為能夠證明金屬苯芳香性特徵的重要反應,是金屬雜芳香化學的...
芳香族親核取代反應(Nucleophilic Aromatic Substitution reaction,SNAr)是親核取代反應的一類,發生在芳香環上。當中一個親核體取代了一個好的離去基團,例如在芳香環上...
芳族取代反應(aromatic substitution)是一個化學反應,分芳族親電取代反應SEAr和芳族親核取代反應SNAr兩類,Ar表示芳基。...
這種取代反應稱為親電取代反應。[用品]苯、鋁片、鐵屑、液溴、硝酸銀、氫氧化鈉、紫色石蕊試液、托盤天平、滴管、鐵架台、導管、玻璃導管、水槽、蒸餾燒瓶、膠塞...
吡嗪為無色結晶;與嘧啶和噠嗪互為同分異構體。不易發生親電取代反應,但易和親核試劑反應。在自然界中,其純品很少存在,但其結構存在於葉酸之中,組成其中的蝶呤...
使親電取代容易發生;當第二個取代基E進入Z的間位時,Z與無星標原子,即電荷密度為1的原子直接相連,而沒連在帶有較多正電荷的星標原子上,Z對E電荷的分散作用...
② 苯環鹵代反應:鹵素對苯環上的取代反應屬親電取代反應。常用的催化劑有鐵、鋁、磷及其鹵化物等: 苯環上如已有取代基,則按取代基的親電取代定位規則進行反應(...
由於它們的高度活潑性以及呋喃和吡咯對於無機強酸的敏感性,其親電取代反應需要比較溫和的條件。例如,呋喃和吡咯進行磺化時要用吡啶-三氧化硫加成物;如用硫酸,環將...
由於氯原子的-I效應太強,雖然動態共軛效應促進了鄰、對位取代,但氯的作用還是使苯環在親電取代反應中變得較難。 [2] 反應機理 ...
