親電取代反應一種親電試劑取代其它官能團的化學反應,這種被取代的基團通常是氫,但其他基團被取代的情形也是存在的。親電取代是芳香族化合物的特性之一,因此一般稱親電取代其實均是特指芳香親電取代。芳香烴的親電取代是一種向芳香環系引入官能團的重要方法。
基本介紹
定義
一般機理
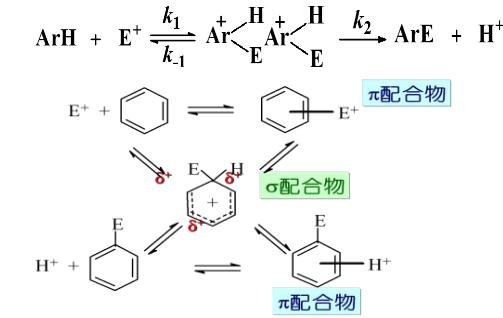
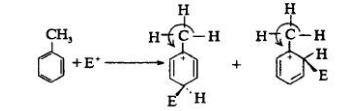
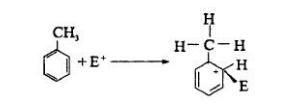
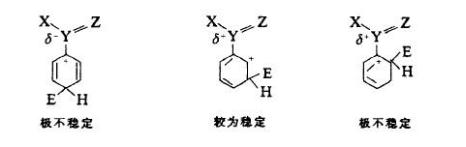
結構與活性的關係
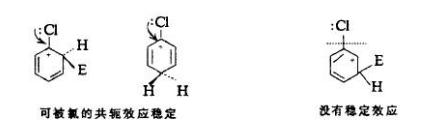

親電取代反應一種親電試劑取代其它官能團的化學反應,這種被取代的基團通常是氫,但其他基團被取代的情形也是存在的。親電取代是芳香族化合物的特性之一,因此一般稱親電取代其實均是特指芳香親電取代。芳香烴的親電取代是一種向芳香環系引入官能團的重要方法。






親電取代反應一種親電試劑取代其它官能團的化學反應,這種被取代的基團通常是氫,但其他基團被取代的情形也是存在的。親電取代是芳香族化合物的特性之一,因此一般稱...
親電取代反應是親電試劑進攻化合物負電部分,取代其它基團的化學反應。一般發生於芳香族化合物,是一種向芳香環系引入官能團的重要方法,是芳香族化合物的特性之一。...
芳香族親核取代反應(Nucleophilic Aromatic Substitution reaction,SNAr)是親核取代反應的一類,發生在芳香環上。當中一個親核體取代了一個好的離去基團,例如在芳香環上...
1 基本信息 2 取代反應分類 ▪ 親核取代反應 ▪ 親電取代反應 ▪ 均裂取代反應 3 芳香取代反應 4 加成與取代反應區別 取代...
親電反應指缺電子(對電子有親和力)的試劑進攻另一化合物電子云密度較高(富電子)區域引起的反應。親電反應屬於離子型反應(ionic reaction)的一種,是有機化學的...
典型的芳香親電取代有苯環的硝化、鹵化、磺化、烷基化和醯基化。這些反應的反應機理大體是相似的。硝化反應有機化合物分子中的氫被硝基(—NO2)取代的反應稱為...
反應的具體機理仍不清楚,可能經過芳正離子。與親電芳香取代反應類似,甲氧基等活化基可促使此反應進行,使產率和選擇性提高V百科往期回顧 詞條統計 瀏覽次數:次 ...
親電加成反應(EA),簡稱親電加成,是親電試劑(帶正電的基團)進攻不飽和鍵引起的加成反應。反應中,不飽和鍵(雙鍵或三鍵)打開,並與另一個底物形成兩個新的σ鍵...
親電取代反應也可分為兩種機制,即單分子親電取代SE1和雙分子親電取代SE2,這與脂肪親核取代反應可分為SN1和SN2是類似的。...
親電體(英語:Electrophile,意思為電子喜好者)為一化學術語,指在化學反應中對含有可成鍵電子對的原子或分子(親核試劑 nucleophile)有親和作用的原子或分子。...
親電取代反應也可分為兩種機制,即單分子親電取代SE1和雙分子親電取代SE2,這與脂肪親核取代反應可分為SN1和SN2是類似的。SE1反應是分步進行的,反應物首先離解成...
移位芳香親核取代反應,芳香族化合物的親核取代反應(SNAr)是重要的有機反應,得到廣泛的套用。SNAr 反應作為能夠證明金屬苯芳香性特徵的重要反應,是金屬雜芳香化學的...
Houben-Hoesch反應,酚或酚醚一類活潑的芳香族化合物與質子酸(HCI,HBr,H2SO4等...它比苯酚更容易發生親電芳香取代反應和Houben - Hoesch反應。用間苯二酚製造的...
在芳香胺親電取代反應中,H2N-,RNH-,R2NH-,ArNH-等都是鄰對位定位基,而與之對應的銨鹽H3N+ 等卻是間位定位基。鹵代反應1.鹵代:苯胺直接鹵代時,除與碘...
芳香性是指在化學性質上表現為易進行親電取代反應,不易進行加成反應和氧化反應,這種物理,化學性質稱為芳香性。芳香性的特徵是環狀閉合共軛體系,π電子高度離域,...
取代是指有機分子裡的某些原子或原子團通過化學反應被其他原子或原子團所替代。包括親核取代和親電取代。...
芳香族化合物硝化的反應機理為:硝酸的-OH基被質子化,接著被脫水劑脫去一分子的水形成硝醯正離子(nitronium ion,NO2)中間體,最後和苯環行親電芳香取代反應,並...
含有取代基的苯衍生物,在進行芳香族親電取代反應時,原有的取代基,對新進入的取代基主要進入位置,存有一定指向性的效應。 這種效應稱為取代基定位效應(Substituent...
這個反應是一個典型的親電芳香取代反應,親電試劑是二氯卡賓(:CCl2),但僅有苯環上富電子的酚類(實際上是酚基負離子)才可發生此類反應。...
它們容易發生親電取代反應、對熱比較穩定,主要來自石油和煤焦油。苯環 有些分子中雖然不含苯環但也具有與苯相似的芳香性的化合物,稱為非苯芳香化合物,如草鹽、...
種芳香族化合物Ar'一Y參加反應時,除生成Ar—F外,還生成Ar—Ar'一Y,且Ar在Ar'環上的位置受Ar'一Y中定位基Y的支配,說明Ar+對Ar'一Y進行了親電取代反應。...
取代反應可細分為:親核取代反應(親核脂肪取代反應,SN1、SN2機理、親核芳香取代反應(NAS)、親核醯基取代反應)、親電取代反應(ES)(親電芳香取代反應(EAS))和自由基...
苯+ RCOCl=芳香酮從上述反應可看出,反應首先由正電基團或缺電子試劑進攻苯環引起的,這些試劑稱為親電試劑.與苯所發生的取代反應稱為親電取代反應.用下列通式表示...
吡啶及其衍生物比苯穩定,其反應性與硝基苯類似。典型的芳香族親電取代反應發生在3、5位上,但反應性比苯低,一般不易發生硝化、鹵化、磺化等反應。吡啶是一個弱...
定位效應,有機化學中指:含有取代基的苯衍生物,在進行芳香族親電取代反應時,原有的取代基,對新進入的取代基主要進入位置,存有一定指向性的效應。在社會心理學中,...
