氣體製取的目的
氣體製取是
實驗化學中的一項基本技能,氣體製取的目的是製備純淨的氣體以便於實驗等工作。因此製取氣體需要考慮很多因素,以便達到目的。
基本步驟
氣體製取是化學實驗的一部分,因此也需要確定方案以便實驗順利進行。
確定生成氣體的反應
通常一種氣體可能由多種反應產生,例如,對於
氯氣,既可以加熱
濃鹽酸與
二氧化錳得到,也可以
電解食鹽水得到,也可以電解熔融的
氯化鈉得到。但是限於實驗室的條件與實驗技術,並不是所有反應都適合實驗室製備、收集氣體,如電解飽和食鹽水得到的氯氣是潮濕的,電解氯化鈉不便於收集,同時耗費太多資源。因此在製取氣體時一定要考慮是否便於
收集、反應條件、
經濟性等多種因素。
確定裝置
確定了反應之後,就要考慮反應裝置。
考慮實驗細節
實驗中有一些細節是需要考慮的。如何時開始
加熱,何時完成收集。這些細節可能影響到氣體的純度或者引起危險。例如:排水收集
氧氣時,剛開始有氣泡不能收集、導管不能伸入集氣瓶太長不便於取出;排空氣法二氧化碳時要在結束時眼前用燃燒的木條檢驗是否集滿。
進行實驗
一定要檢查氣密性。按照具體的步驟進行實驗,實驗時要小心謹慎,注意觀察現象並填寫實驗報告。
裝置
一般的連線方式是 反應裝置 → (純化裝置) → 收集裝置 → (後續處理)。
反應裝置
對於反應裝置,主要考慮:
反應條件:是否需要加熱。
反應物的物態:是否全是固體、是否有液體。
通常有:固體液體常溫裝置,固體加熱裝置,固體液體加熱裝置。
純化裝置
反應時通常可能伴有
副反應或者雜質。為了防止這些雜質導致產品不純,因此要將氣體通過一些裝置(洗氣瓶等),去除這些雜質。
通常有如下幾類:
收集裝置
考慮氣體的密度、在某些液體的溶解度:確定收集方式。例如二氧化碳易溶於水所以不適用排水法,但可以排空氣或者排油;SO3易溶於水但不易溶於煤油,因此可以排油等。
尾氣處理
一些氣體若進入大氣會造成污染、引發人畜中毒,因此在實驗時要把混有這種氣體的尾氣處理掉。
常見方法:
常見氣體的製備
這裡大體介紹一些氣體的製取方法與實驗裝置。具體的實驗要視情況而定。
氯氣
製取原理:強氧化劑氧化含氧化合物製取方程式:MnO
2+4HCl(濃) =加熱= MnCl
2+Cl
2↑+2H2O
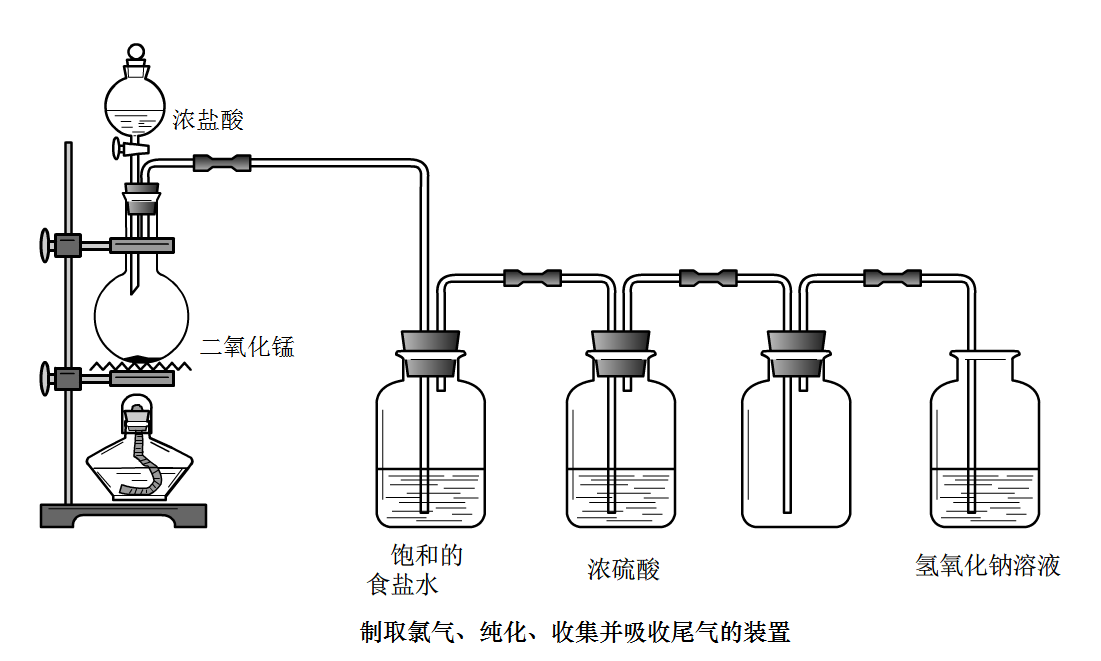 製取氯氣的裝置
製取氯氣的裝置檢驗:能使濕潤的藍色石蕊試紙先變紅後褪色;
除雜質:先通入飽和食鹽水(除HCl),再通入濃H
2SO
4(除
水蒸氣)
收集:排飽和食鹽水法或向上排氣法
尾氣回收:Cl2+2NaOH = NaCl+NaClO+H2O
此實驗的一些注意事項:1、
鹽酸一定是
濃鹽酸,
稀鹽酸在此條件下不與
二氧化錳反應;而實驗時濃鹽酸濃度逐漸降低,到達一定限度後不再反應。因此實際實驗中所添加的的濃鹽酸實際的量要比理論值多一些。2、要使用NaCl的飽和溶液出去
HCl氣體。HCl可在NaCl的飽和溶液中溶解,但是Cl
2基本不溶於NaCl的飽和溶液。3、
燒瓶加熱要墊
石棉網。
氧氣
製取原理:H2O2分解、KMnO4分解、KClO3在MnO2催化與加熱下分解
檢驗:能使帶火星的木條復燃;
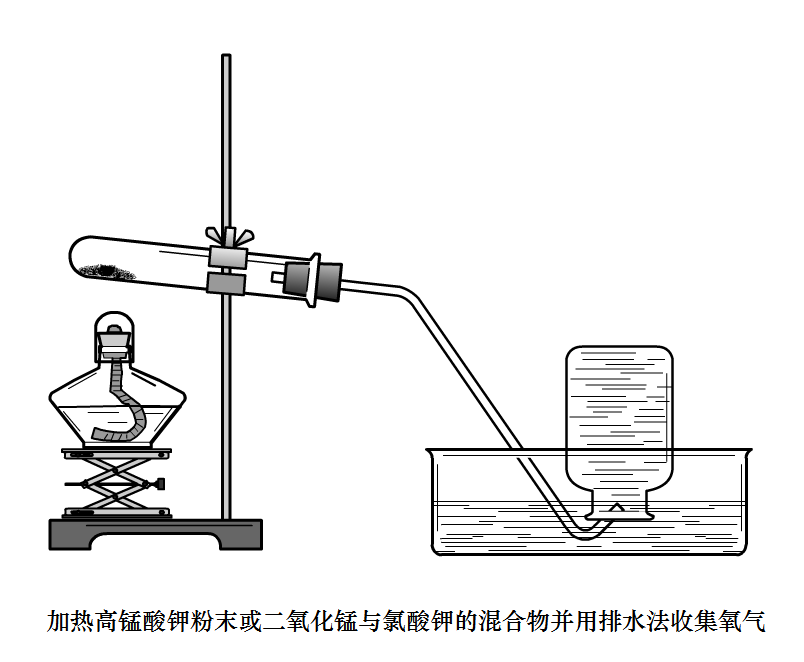
收集:排水法,向上排空氣法;
此實驗的一些注意事項:
如果使用
過氧化氫分解法製取,要注意H
2O
2加入MnO
2中。
如果使用長頸漏斗,要注意液封;使用加熱高錳酸鉀製取氧氣,要注意試管略向下傾斜,同時注意預熱,最好在試管口墊棉花以免高錳酸鉀進入導管;
使用加熱
氯酸鉀與二氧化錳製取氧氣時注意:1、
絕對不能像加熱高錳酸鉀一樣在試管口墊棉花!高錳酸鉀是強氧化劑,會與棉花反應;2、
副反應有Cl
2等氣體生成。3、檢查
氯酸鉀的純度。
排水法收集時注意:1、剛開始有氣泡冒出是有可能是原裝置中的空氣,不要收集。2、導管口稍稍伸入集氣瓶即可;3、水槽中的水不要加太滿。
氨氣
製取原理:固體
銨鹽與固體
強鹼的複分解
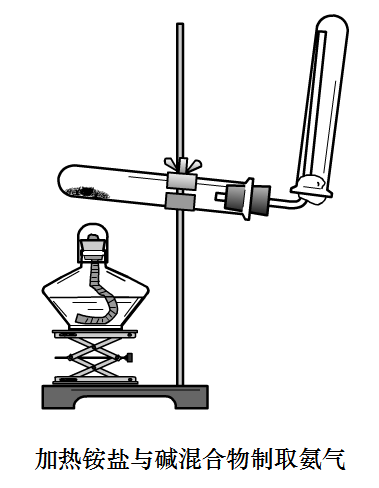 加熱製取氨氣的裝置
加熱製取氨氣的裝置製取方程式:Ca(OH)2+2NH4Cl = CaCl2+NH3↑+2H2O
裝置:略微向下傾斜的大試管,加熱
檢驗:濕潤的紅色石蕊試紙,變藍
除雜質:通入鹼石灰(除水蒸氣)
收集:向下排氣法
此實驗的一些注意事項:試管口略向下傾斜;如圖所示,收集的試管要塞一團棉花;
硫化氫
製取方程式:FeS+2HCl = FeCl2+H2S↑
除雜質:先通入飽和
NaHS溶液(除HCl),再通入固體CaCl
2(或P
2O
5)(除水蒸氣)
收集:向上排氣法
此實驗的一些注意事項:
硫化氫不僅氣味不佳,而且有毒,可以使用反應CuSO
4+H
2S=CuS↓+H
2SO
4來除去。
二氧化硫
製取原理:穩定性強酸與不穩定性弱酸鹽的複分解
製取方程式:Na
2SO
3+H
2SO
4 = Na
2SO
4+SO
2↑+H
2O
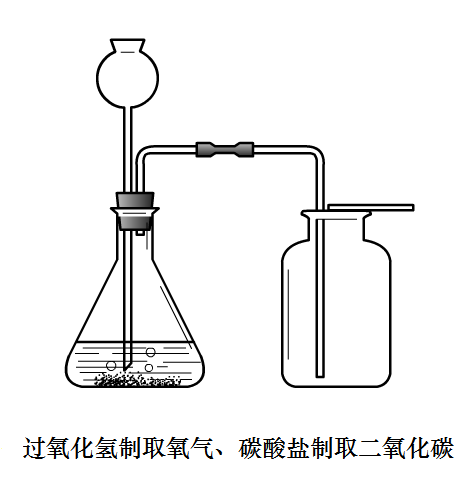
檢驗:先通入品紅試液,褪色。後加熱又恢復原紅色;
除雜質:通入濃H2SO4(除水蒸氣)
收集:向上排氣法
氯化氫
製取原理:高沸點酸與金屬氯化物的複分解
製取方程式:NaCl+H2SO4 = Na2SO4+2HCl↑
裝置:分液漏斗,圓底燒瓶,加熱
檢驗:通入
AgNO3溶液,產生白色沉澱,再加稀HNO
3沉澱不溶
除雜質:通入濃硫酸(除水蒸氣)
收集:向上排氣法
二氧化氮、一氧化氮
製取方程式:Cu+4HNO3 = Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
裝置:分液漏斗,圓底燒瓶(或用大試管,錐形瓶)
檢驗:
二氧化氮:紅棕色氣體,通入AgNO3溶液顏色變淺,但無沉澱生成
收集:二氧化氮:向上排氣法 一氧化氮:特殊方法
尾氣處理:3NO2+H2O = 2HNO3+NO NO+NO2+2NaOH = 2NaNO2+H2O
此實驗的注意事項:
硝酸在不同濃度下與不活潑金屬生成不同的氣體。要注意濃度。製取
一氧化氮時,不要用排空氣法。一氧化氮與氧氣反應。
一氧化碳
製取原理:濃硫酸對有機物的脫水作用
製取方程式:HCOOH =濃硫酸、加熱= CO↑+H2O
檢驗:燃燒,藍色火焰,無水珠,產生氣體能使澄清石灰水變渾濁
除雜質:通入濃硫酸(除水蒸氣)
甲烷
製取方程式:CH3COONa+NaOH =加熱= CH4↑+Na2CO3
裝置:略微向下傾斜的大試管,加熱
收集:排水法或向下排空氣法
乙烯
製取方程式:CH3CH2OH =濃硫酸、加熱= CH2=CH2↑+H2O
除雜質:通入NaOH溶液(除SO2、CO2),通入濃硫酸(除水蒸氣)
收集:排水法
此實驗的注意事項:
控制溫度。
乙醇可以在
濃硫酸和高溫的
催化發生脫水反應,隨著溫度的不同生成物也不同。如果溫度在140℃左右生成物是
乙醚。
乙炔
製取原理:
電石強烈吸水作用
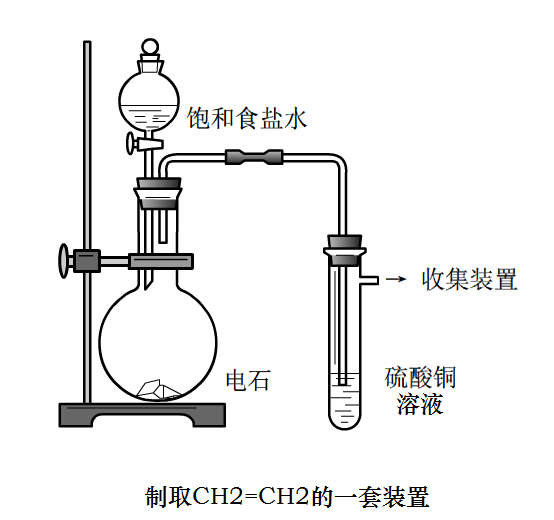 製取裝置
製取裝置製取方程式:CaC2+2H2O = Ca(OH)2+CH≡CH↑
檢驗:無色氣體,能燃燒,產生明亮的火焰,並冒出濃的黑煙
此實驗的注意事項:
不要使用蒸餾水與電石反應,要使用飽和食鹽水,避免劇烈反應引發事故。
 製取氯氣的裝置
製取氯氣的裝置

 製取裝置
製取裝置 加熱製取氨氣的裝置
加熱製取氨氣的裝置