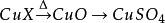理化性質,物理性質,化學性質,製備方法,用途,安全風險,健康危害,泄漏處理,防護措施,急救措施,安全標識,危險標識,儲存運輸,運輸信息,儲存方法,檢測,檢測方法,環境標準,
理化性質
物理性質
外觀與性狀:無水硫酸銅為灰白色粉末,易吸水變藍綠色的五水合硫酸銅。
熔點:560℃。
密度:3.606g/mL (25ºC)
蒸氣壓:7.3mm Hg(25ºC)
溶解性:溶於水、甲醇。不溶於乙醇
化學性質
1.極易吸收空氣中的水汽而變成水合物。加熱後失去結晶水,加熱到102℃失去兩個結晶水;113℃失去三個結晶水;258℃失去全部結晶水;當加熱溫度達653℃時,開始分解生成CuO和SO3,在720℃時分解結束。
生成結晶水的變化如下:
在不同的溫度下發生的變化如下:
2.與活動順序位於銅以前的單質發生置換反應,如鐵、鋅,但不能與過於活潑的金屬(如鈉、鉀等)置換。
3.與鹼反應
與氨水反應,少量時生成氫氧化銅,過量時生成配合物硫酸四氨合銅。
現象:向硫酸銅溶液中加入少量氨水,有藍色沉澱生成;繼續加入氨水,沉澱溶解,生成深藍色溶液。加入乙醇,有深藍色沉澱析出。
4.與鹽的反應
5.電化學反應
在中學和普通化學教育中,硫酸銅被用作原電池的電解液,通常作為陽極溶液。例如,在銅—鋅原電池中,硫酸銅溶液中的銅離子從鋅中吸收電子,形成金屬銅。
製備方法
1.硫酸法
此方法由於會產生有害氣體二氧化硫,因此實際套用較少
另一種方法是將銅粉在600~700℃下進行焙燒,氧化成為氧化銅,再經硫酸分解、澄清除去不溶雜質,經冷卻結晶、過濾、乾燥,製得硫酸銅成品;
反應式如下:
 硫酸銅結構式
硫酸銅結構式2.電解液回收法
廢電解液(含Cu50~60g/L,H2SO4180~200g/L)與經焙燒處理的銅泥製成細銅粉進行反應,反應液分離沉降後清液經冷卻結晶、分離、乾燥,製得硫酸銅成品;
3.化學濃縮結晶法
採用低品位氧化銅礦,粉碎至一定粒度,加入硫酸浸漬,加入溶銅沉鐵劑,獲得銅鐵比大於100的硫酸銅溶液,然後加入化學濃縮劑進行濃縮,排走70%~90%的水分,最後經蒸發、冷卻結晶、分離、風乾,製得硫酸銅成品;
4.將五水合硫酸銅置於瓷皿中,於通風良好處,在砂浴上加熱,溫度不高於220℃。不斷攪動,直至藍色全部消失為止。將製得的白色粉末研細(如製品呈灰白色證明加熱過度)即為無水硫酸銅;
5.回收法
回收氮肥廠合成氨原料氣時銅洗塔中醋酸銅氨溶液中的銅化合物沉澱物(習慣上稱之為銅污),在700℃焙燒後,經氧化成氧化銅後與硫酸反應生成硫酸銅。
用途
用作分析試劑,例如可用於生物學中配置鑑定還原糖的斐林試劑和鑑定蛋白質的
雙縮脲試劑的B液,但通常是現配現用;
用作食品級螯合劑和澄清劑,用於皮蛋和葡萄酒生產工藝中;
工業領域。用於製造其他銅鹽如氯化亞銅、氯化銅、焦磷酸銅、氧化亞銅、醋酸銅、碳酸銅,銅單偶氮染料如活性艷藍、活性紫等;塗料工業用於生產船底防污漆;電鍍工業用作全光亮酸性鍍銅主鹽和銅離子添加劑;印染工業用作媒染劑和精染布的助氧劑;有機工業用作合成香料和染料中間體的催化劑,甲基丙烯酸甲酯的阻聚劑。無水鹽用於催化轉縮醛反應。無水鹽與高錳酸鉀反應生成一種
氧化劑,用於
伯醇的轉換。
農業領域,與石灰水混合後生成波爾多液,作為殺菌劑,用於控制作物上的真菌,防止果實等腐爛;由於銅離子對魚有毒,用量必須嚴格控制。養殖業也用作飼料添加劑微量元素銅的主要原料;
用於醇類和有機化合物的脫水劑。氣體乾燥劑。
化學教育,硫酸銅通常被包含在兒童的化學實驗試劑中,用於晶體的生成試驗和
電鍍銅實驗。因為它的毒性,不建議幼兒使用。硫酸銅還可以用來演示晶體失水風化和得到結晶水的過程。 在國中實驗考試中,利用硫酸銅與鐵發生的置換反應驗證質量守恆定律。還可製取硫酸。
醫療領域用作催吐劑。
安全風險
健康危害
侵入途徑:吸入、食入。
健康危害:對胃腸道有刺激作用,誤服引起噁心、嘔吐、口內有銅性味、胃燒灼感。嚴重者有腹絞痛、嘔血、黑便。可造成嚴重腎損害和溶血,出現黃疸、貧血、肝大、血紅蛋白尿、急性腎功能衰竭和尿毒症。對眼和皮膚有刺激性。長期接觸可發生接觸性皮炎和鼻、眼黏膜刺激並出現胃腸道症狀。
毒理學資料:
毒性:屬中等毒性。
急性毒性:LD50:300mg/kg(大鼠經口);33mg/kg(小鼠腹腔)
危險特性:未有特殊的燃燒爆炸特性。受高熱分解產生有毒的硫化物煙氣。
燃燒(分解)產物:氧化硫、氧化銅。
泄漏處理
隔離泄漏污染區,周圍設警告標誌。應急人員戴好防毒面具和手套。用大量水沖洗,經稀釋的洗液放入廢水系統。如大量泄漏,收集回收或無害處理後廢棄。
防護措施
呼吸系統防護:作業工人應該佩戴防塵口罩。
眼睛防護:可採用安全面罩。
防護服:穿工作服。
手防護:必要時戴防護手套。
其它:工作現場禁止吸菸、進食和飲水。工作後,淋浴更衣。注意個人清潔衛生。實行就業前和定期的體檢。
急救措施
皮膚接觸:脫去污染的衣著,用大量流動清水徹底沖洗。
眼睛接觸:立即翻開上下眼瞼,用流動清水或生理鹽水沖洗。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。呼吸困難時給輸氧。呼吸停止時,立即進行人工呼吸。就醫。
食入:誤服者用0.1%亞鐵氰化鉀或硫代硫酸鈉洗胃。也可內服大量雞蛋清以保護冒黏膜及甜茶收斂,並用鹽類瀉劑,排除腸道內積存的銅製劑農藥。體內銅過量時可用絡合劑如依地酸二鈉鈣,每日1克,用50%葡萄糖溶液或生理鹽水20~40毫升稀釋後靜注射。並及時就醫。
安全標識
S22 不要吸入粉塵。
S60 本物質殘餘物和容器必須作為危險廢物處理。
S61 避免排放到環境中。
危險標識
R22 吞食有害。
R36/38 刺激眼睛和皮膚。
R50/53 對水生生物有極高毒性。
儲存運輸
運輸信息
危險運輸編碼:UN 3077
危險品標誌: 有害,危害環境
包裝類別:Z01。
運輸注意事項:起運時包裝要完整,裝載應穩妥。運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞。嚴禁與酸類、鹼類、食用化學品等混裝混運。運輸途中應防曝曬、雨淋,防高溫。車輛運輸完畢應進行徹底清掃。
儲存方法
儲存於陰涼、乾燥、通風良好的庫房。遠離火種、熱源。保持容器密封。應與酸類、鹼類、食用化學品分開存放,切忌混儲。儲區應備有合適的材料收容泄漏物。
檢測
檢測方法
| 監測方法 | 來源 | 類別 |
|---|
重量法 | GB11899-89 | 水質(硫酸鹽) |
鉻酸鋇光度法 | 《水和廢水監測分析方法》,國家環保局編 | 水質(硫酸鹽) |
鉻酸鋇間接原子吸收法 | 《水和廢水監測分析方法》,國家環保局編 | 水質(硫酸鹽) |
EDTA滴定法 | 《水和廢水監測分析方法》,國家環保局編 | 水質(硫酸鹽) |
原子吸收法 | | 水質(銅) |
環境標準
中國(GB/T14848-93) | 地下水質量標準(mg/L) | I類50;II類150;III類250
;IV類350;V類350以上(硫酸鹽) |
中國(GHZB1-1999) | 地表水環境質量標準(mg/L) | I類250以下;II類250;III類250;IV類250;V類250(硫酸鹽) |
中國(GB5749-85) | 生活飲用水水質標準 | 250mg/L(硫酸鹽) |
前蘇聯(1978) | 漁業水中最高容許濃度 | 4μg/L |
前蘇聯(1975) | 水體中有害物質最高允許濃度 | 0.1mg/L(以銅計) |
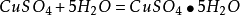
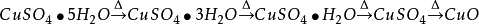
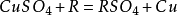

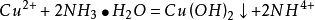
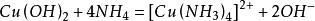
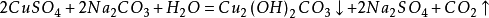
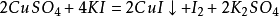

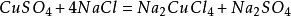
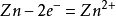
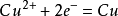
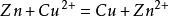

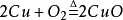

 硫酸銅結構式
硫酸銅結構式