基本介紹
- 中文名:蛋白質變性
- 外文名:protein denaturation
- 學科:生物
- 變性原因: 蛋白質受物理或化學因素的影響
- 變性結果: 蛋白質活性喪失
- 影響因素:質子
蛋白質
變性原因
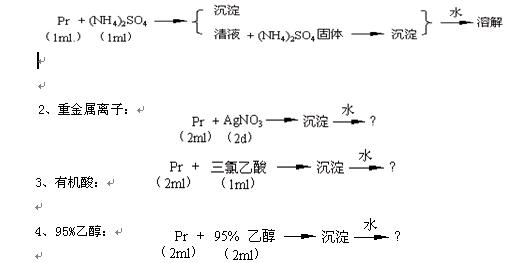 蛋白質變性
蛋白質變性變性結果
生物活性喪失
某些理化性質
生物化學性質
致變因素
 可促使蛋白質變性 *鹽析
可促使蛋白質變性 *鹽析
 蛋白質變性
蛋白質變性 可促使蛋白質變性 *鹽析
可促使蛋白質變性 *鹽析蛋白質變性(protein denaturation)是指蛋白質分子中的醯氧原子核外電子,受質子的影響,向質子移動,相鄰的碳原子核外電子向氧移動,相對裸露的碳原子核,被親核加成,...
蛋白質的變性作用是蛋白質的一種不可逆的化學反應。...... 不能再使它們恢復為原來的蛋白質,這種作用就叫做蛋白質的變性作用.蛋白質變性後,就失去了原來的可溶性,...
可逆的變性,指在一定條件下,蛋白質沉澱,但是空間結構不改變,當撤去變性條件後,蛋白恢復活性。例如鹽析,在高濃度鹽中蛋白質變性沉澱,但加入適量水使鹽溶液濃度降低...
蛋白質的變性(denaturation),在某些物理和化學因素作用下,其特定的空間構象被破壞,即有序的空間結構變成無序的空間結構,從而導致其理化性質的改變和生物活性的喪失,...
在變性條件不劇烈,變性蛋白質內部結構變化不大時,除去變性因素,在適當條件下變性蛋白質可恢復其天然構象和生物活性,這種現象稱為蛋白質的復性(renaturation)。蛋白質...
蛋白質分子受到某些物理、化學因素的影響時,發生生物活性喪失,溶解度降低等性質改變,但是不涉及一級結構改變,而是蛋白質分子空間結構改變,這類變化稱為蛋白質變性作用...
蛋白質分子易受外界因素(如:溫度、變性劑等)影響而發生構象變化,從而喪失生物活性,引起物理化學性質的異常變化,這一過程稱為蛋白質變性。由加熱使其變性的熱致變性...
變性蛋白(proteindenaturation)是蛋白質在某些物理和化學因素作用下其特定的空間構象被改變,從而導致其理化性質的改變和生物活性的喪失。蛋白質是由多種胺基酸通過肽鍵...
當蛋白質受到外界因素作用時,蛋白質分子結構從有規則的排列變成不規則排列,其物理性質也發生改變,並失去原有的生理活性,即蛋白質發生變性,變性蛋白質在水中的溶解度...
蛋白質的復性(renaturation),指蛋白質變性程度較輕,去除變性因素後,有些蛋白質仍可恢復或部分恢復其原有的構象和功能。...
學科:生物學 詞目:蛋白質變性恢復 英文:renaturation of protein 釋文:變性了的蛋白質和核酸等,由於去除了引起其變性的因素,從而恢復其原來的立體結構和生物活性...
蛋白質變性 在熱、酸、鹼、重金屬鹽、紫外線等作作用下,蛋白質會發生性質上的改變而凝結起來.這種凝結是不可逆的,不能再使它們恢復成原來的蛋白質.蛋白質的...
蛋白質的生物活性是指蛋白質作為酶、激素、抗原與抗體等所具有生物學功能。生物活性喪失是蛋白質變性的重要特徵,因為蛋白質的生物活性與其構想密切相關,有時蛋白質的...
變性一般分為 :蛋白質代謝障礙、脂肪代謝障礙、糖代謝障礙、礦物質代謝障礙和病理性色素沉著等。常見的變性有腫脹、水性變、脂肪變、玻璃樣變、澱粉樣變、病理性...
雞子白的蛋白質,在營養上是優良的,因它含所有的必需胺基酸。蛋白性味 ...已知的未被修飾的大蛋白應該作為標誌,變性的修飾的蛋白的PI估計約在±0。25個...
1、蛋白質代謝以胺基酸為核心,細胞內外液中所有游離胺基酸稱為游離胺基酸庫,其...1、胃中的消化:胃分泌的鹽酸可使蛋白變性,容易消化,還可激活胃蛋白酶,保持其...
Macbeath和Schreiber首先用一層小牛血清白蛋白(BSA)修飾玻片,可以防止固定在表面上的蛋白質變性。由於賴氨酸廣泛存在於蛋白質的肽鏈中,BSA中的賴氨酸通過活性劑與點...
系指在病變的細胞或間質組織中,出現均勻一致、無結構、半透明狀蛋白質蓄積,在HE染色切片中呈嗜伊紅均質狀。分為細胞內玻璃樣變性、纖維結締組織玻璃樣變性、細...
膠體性質變性沉澱顯色反應活性蛋白質種類性質及功能 編輯 活性蛋白質的種類非常多,一般根據來源與特性可分為:免疫球蛋白、活性乳蛋白、溶菌酶、大豆蛋白等。...
解剖後肌肉ph降低的速度或程度減少了25%~50%,肌肉蛋白質變性降低了66%~85%。通過灰色關聯度分析,合作豬的最佳解剖體重為40kg肌肉蛋白質為24.3%,肌肉水分含量...
腦白質變性 腦白質,是大腦內部而神經纖維聚集的地方,由於其區域比細胞體聚集的大腦表層顏色淺,故名腦白質。如腦白質中的中樞神經細胞的髓鞘損害,則會引起腦白...
構建蛋白質微陣列的最初努力是為了研究賴氨酸或半胱氨酸殘基的固有活性,希望表面上的反應基以共價方式捕捉蛋白質,但這會讓活性位點變得難以獲得,或導致蛋白質變性...
