在熱力學之中,與外界(環境)沒有物質交換,但有能量交換的系統稱為封閉系統(Closed system)。孤立系統一般情況下粒子數守恆。
基本介紹
定義
適用範疇
數學表達式
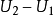

在熱力學之中,與外界(環境)沒有物質交換,但有能量交換的系統稱為封閉系統(Closed system)。孤立系統一般情況下粒子數守恆。
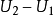
在熱力學之中,與外界(環境)沒有物質交換,但有能量交換的系統稱為封閉系統(Closed system)。孤立系統一般情況下粒子數守恆。...
藥品名稱纖維蛋白封閉系統英文名稱Fibrin Glue別名纖維蛋白黏合膠;纖黏膠;康普欣;纖維蛋白膠;Fibrin Sealant (Human)for Surgery;FG;fibrin-fibronectin sealing system...
開放系統指與外界環境存在物質、能量、信息交換的系統。開放系統是與封閉系統相對而言的。開放系統理論是貝塔朗菲在20世紀40年代開創的,而後把開放系統作為一般系統的...
冷/熱通道封閉系統是一項套用於降低因工作而發熱的設備溫度的技術。主要套用於數據中心機房。...
封閉原理是指任何一個系統里的領導手段必須構成一個連續封閉的迴路。作為領導手段的機構來說,執行機構必須確切無誤地貫徹指揮中心的命令,為了保證這一點,應有監督...
密閉循環系統 closca-recireulatioa system指循環冷卻 水不與大氣直接接觸冷卻的循環冷卻水系統。在此系統中, 工藝介質散發的熱,通過主換熱器轉移到密閉冷卻水環路,...
一般系統論是關於任意系統研究的一般理論和方法。它雖源於理論生物學中的生物機體論,但其與哲學密切相關,是處於具體科學與哲學之間,具有橫斷科學性質的一種基本理論...
熱力學系統是指由大量微觀粒子組成,並與其周圍環境以任意方式相互作用著的巨觀客體。熱力學的研究對象,簡稱系統,或熱力系、熱力系統。它不僅是巨觀的,而且是有限的...
封閉型市場即Closed Market,是指某個區域市場有一批固定的產品供應者、經銷商和顧客,這批人形成了“既得利益集團”,它們會設立各種有形的、無形的壁壘,力圖使...
