簡介,生物學性狀,(一)形態結構,(二)培養特性,(三)病毒型別,(四)抵抗力,致病性與免疫性,(一)流行特點,(二)致病性,(三)免疫性,微生物學診斷,(一)病毒分離,(二)血清學檢查,防治原則,(一)一般預防,(二)特異預防,(三)治療原則,
簡介
HFRS病毒首先由韓國李鎬汪等在1978年從該國疫區捕獲的黑線姬鼠肺組織中分離出,並根據分離地點稱為漢灘病毒(Hantaan virus)。此後各地相繼從不同動物及病人體內分離出許多株病毒,現國際上通稱為HFRS病毒。根據此病毒的形態學和分子生物學特徵。目前已將其歸入尼亞病毒科(Bunyaviridae) ,另立為一個新屬, 命名為漢坦病毒屬(Hantavirus)。
生物學性狀
(一)形態結構
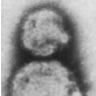
病毒體呈圓形或卵
圓形,
直徑90~110nm,有
囊膜,囊膜上有突起。HFRS病毒的核酸為單股負鏈RNA,分為L、M、S三個片段。分子量分別為2.7×106、1.4×106和0.6×106道爾頓。三個片段的鹼基序列互不相同,但都具有同樣的3′末端,為“3′AUCAUCAUCUG”,這一序列不同於
布尼亞病毒科的其他屬病毒。HFRS病毒具有四種蛋白組成,即N、G1、G2和L。N為核蛋白,由S片段編碼,其主要功能是包裹病毒RNA的三個片段,該蛋白免疫原性強。G1和G2均為糖蛋白,由M片段編碼,上面有中和抗原位點和血凝活位點。這二種抗原位點是獨立存在的,但也可部分重疊。L為RNA多聚酶,由L片段編碼,在病毒複製中起重要作用。HFRS病毒的成熟方式為芽生成熟,其成熟過程與細胞的高爾基氏體和內質網有關。病毒在pH5.6~6.4時可凝集鵝紅細胞。
(二)培養特性
多種傳代、原代及二倍體細胞均對HFRS病毒敏感,實驗室常用非洲綠猴腎細胞(VeroE6)、人肺癌傳代細胞(A549)等來分離培養該病毒。病毒在細胞內一般不引起可見的細胞病變,通常需採用免疫學方法檢測證實。易感動物有多種,如黑線姬鼠、長爪沙鼠、小白鼠、大白鼠等,但除了小
白鼠乳鼠感染後可發病及致死外,其餘均無明顯症狀。
(三)病毒型別
已證實HFRS病毒與其他出血熱病毒無關,與布尼亞病毒科其他4個屬的病毒也無血清學關係。採用血清學方法(主要是空斑減少中和試驗)以及RT—PCR技術和酶切分析方法,可將HFRS病毒分為不同型別,即漢灘病毒(Ⅰ型,又稱野鼠型)、漢城病毒(Ⅱ型,又稱家鼠型)、普馬拉病毒(Ⅲ型,又稱棕背鼠型)、希望山病毒(Ⅳ型,又稱草原田鼠型)、泰國病毒(Ⅴ型)、Dobrava病毒(Ⅵ型)、 Thottapalaym病毒(Ⅶ型)以及1993年在美國西南部暴發的漢坦病毒肺綜合徵的病原。其中前4型經世界衛生組織漢坦病毒參考中心認定的,而後4型則尚未最後認定。從我國不同疫區、不同動物及病人分離出的HFRS病毒,分屬於Ⅰ型和Ⅱ型,兩型病毒的抗原性有交叉。
(四)抵抗力
HFRS病毒抵抗力強。對酸(pH3)和丙酮、氯仿、乙醚等脂溶劑敏感。一般消毒劑如來蘇爾、新潔爾滅等也能滅活病毒。病毒對熱的抵抗力較弱,56~60℃30分鐘可滅活病毒。紫外線照射(50cm、30分鐘)也可滅活病毒。
致病性與免疫性
(一)流行特點
目前世界上已發現能攜帶本病毒的鼠類等動物百餘種,疫源地遍及世界五大洲。在
亞洲、
歐洲、非洲和美洲28個國家有病例報告。我國是HFRS疫情最嚴重的國家,自本世紀30年代首先在黑龍江省孫吳縣發現此病後,疫區逐漸擴大,現已波及二十八個省、市、自治區。自80年代中期以來,年發病人數超過10萬,病死率為3~5%,有的地區高達10%。
黑線姬鼠和褐家鼠是我國各疫區HFRS病毒的主要宿主動物和傳染源。此病有明顯的地區性和季節性,這種地區性和季節性與鼠類的分布與活動有關。Ⅰ型HFRS發病多集於秋冬之間,Ⅱ型則多集中於春夏之間。HFRS的傳播途徑尚未完全肯定,認為可能的途徑有3類5種,即動物源性傳播(包括通過呼吸道、消化道和傷口3種途徑)、蟲媒傳播和垂直傳播。其中傳播源性傳播是主要的傳播途徑,即攜帶病毒的動物通過唾液、尿、糞排出病毒污染環境,人或動物通過呼吸道、消化道攝入或直接接觸感染動物受到傳染。蟎類也可能是一病的傳播媒介。
(二)致病性
潛伏期一般為兩周左右,起病急,發展快。典型病例具有三大主症,即發熱、出血和腎臟損害。臨床經過分為發熱期、低血壓休克期、水尿期、多尿期和恢復期。HFRS的發病機理很複雜,有些環節尚未完全搞清。目前一般認為病毒直接作用是發病的始動環節,而免疫病理損傷也起重要作用。病毒感染造成病毒血症以及全身毛細血管和小血管損傷,引起高熱、寒戰、乏力、全身酸痛、皮膚和黏膜出現出血點或出血斑,重者還可有腔道或各臟器出血、腎臟損害出現血尿、蛋白尿,電解質紊亂。廣泛的毛細血管和小血管損傷引起的出血、血漿滲出和微循環障礙等造成低血壓或休克。病程早期血液中lgE水平增高,提示Ⅰ型變態反應可能通過血管活性物質的作用,使小血管擴張,滲出增加。另外在早期病人體內即可出現大量循環免疫複合物,在血管壁、血小板、腎小球及腎小管上有免疫複合物沉積,血清補體水平下降;血清中也可檢出抗基底膜和抗心肌抗體,這些現象表明Ⅲ型和Ⅱ型變態反應造成的免疫病理損傷也參與了HFRS的致病。
(三)免疫性
人對HFRS病毒普遍易感。過去認為HFRS以顯性感染為主,但近年來的監測研究表明,人群感染後僅少數人發病,大部分人呈隱性感染狀態,特別是Ⅱ型疫區的人群隱性感染率更高。感染後抗體出現早,發熱1~2天即可檢測出lgM抗體,第7~10天達高峰;第2~3天可檢測出lgG抗體,第14~20天達高峰,lgG抗體在體內可持續存在30餘年。近年來的研究結果表明,在不同的抗體成份中,對機體起免疫保護作用的主要是由G1和G2糖蛋白刺激產生的中和抗體和血凝抑制抗體,而由N蛋白刺激產生的特異性抗體在免疫保護中也起一定作用。
以往曾認為HFRS病人的細胞免疫功能呈抑制狀態,而近年來的研究表明,細胞免疫在對HFRS病毒感染的免疫保護中起同樣起重要作用。特別是觀察到HFRS病人的抑制性T細胞功能低下,致使殺死性T細胞和B細胞功能相對增強,一些細胞因子(如白細胞介素1、干擾素、腫瘤壞死因子、白細胞介素2受體、前裂腺素E2等)的水平在HFRS的不同病期也有明顯變化。值得指出的是,上述細胸免疫(包括一些細胞因子)與特異性抗體一樣,除參與抗感染免疫,具有抵禦和清除病毒的作用以外,也參與變態反應,即也可能是造成本病免疫病理捐贈傷的原因之一。
HFRS病後可獲持久免疫力,一般不發生再次感染髮病,但隱性感染產生的免疫力多不能持久。
微生物學診斷
(一)病毒分離
病人急性期血液、屍檢組織或感染動物的肺、腎等組織均可用於病毒分離,組織需研磨成懸液。常用Vero-E6細胞分離培養,培養7~14天后,用免疫螢光染色法檢查細胞內是否有病毒抗原,胞漿內出現黃綠色顆粒螢光為陽性。也可取檢材接種易感動物來分離病毒,常用者為小白鼠乳鼠,通過腹腔或腦內接種,接種後逐日觀察動物有無發病或死亡,並定期取動物腦、肺等組織,冰凍切片或將組織研磨成懸液後分別用免疫螢光法或ELISA檢查是否有病毒抗原。用細胞或動物分離培養陰性者繼續盲傳,連續三代陰性者方能肯定為陽性。此外在進行動物實驗時採取嚴格的隔離及防護措施,以防止發生實驗室感染。
(二)血清學檢查
1.檢測特異性lgM 抗體:此抗體在發病後第1~2天即可檢出,急性期陽性率可達95%以上,因此檢測此抗體具有早期診斷價值。根據情況可選用間接免疫螢光法(IFAT)和ELISA,後者又可分為lgM捕捉法和間接法,其中以lgM捕捉法的敏感性和特異性為最好。
2.檢測特異性lgG抗體:病後特異性lgg 抗體出現較早,維持時間很長,因此需檢測雙份血清(間隔至少一周),恢復期血清抗體滴度比急性期升高4倍以上可確診。常用檢測方法為IFAT和ELISA。此兩種方法還可用於血清流行病學調查。
3.檢測血凝抑制抗體:採用血凝抑制試驗檢測病人血清中的特異性血凝抑制抗體,在輔助診斷和流行病學調查中也較常用。
防治原則
(一)一般預防
主要採取滅鼠、防鼠、滅蟲、消毒和個人防護等措施。
(二)特異預防
目前國內外已初步研製出三類HFRS疫苗,即純化鼠腦滅活疫苗(分別由朝鮮、韓國及我國研製)、細胞培養滅活疫苗(包括Ⅰ型疫苗和Ⅱ型疫苗,均由我國研製)和基因工程疫苗(由美國研製)。最近我國研製的二類疫苗已在不同疫區進行大量人群接種,預防效果正在觀察監測之中。
(三)治療原則
對HFRS應堅持“三早一就”(早發現、早休息、早治療、就近治療)。目前尚無特效療法,主要是採取以“液體療法”為基礎的綜合治療措施。有報導病毒唑和病人恢復期血清對早期病人有一定療效。