繼發性白血病(secondary leukemia)是一種可辨認的急性白血病亞型,繼發於化療、放療或有肯定的環境或職業接觸史的急性白血病。
臨床表現,併發症,特點,病因,電離輻射,化療藥物,其他藥物,非治療性物質,發病機制,流行病學,診斷,檢查,實驗室檢查,其它輔助檢查,治療,支持治療,誘導分化劑,刺激骨髓造血藥物,細胞因子,聯合化療,造血幹細胞移植(HSCT),預後,預防,
臨床表現
起病較慢,有明顯的原發病病史和化學藥物使用和(或)放療史,年齡和性別同原發病大多數患者在診斷時表現為不同程度的骨髓衰竭。
一般特點
約70%繼發於使用烷化劑或放療後患者有白血病前期的表現,典型的白血病前期階段持續約11.2個月。患者有乏力疲倦等貧血相關症狀可伴有皮膚淤點、淤斑、鼻出血等出血症狀,可有發熱但無明顯感染徵象;鬼臼毒素類(VP16或VM26)或其他的拓撲異構酶Ⅱ抑制劑導致的繼發性白血病常無白血病前期階段表現。
骨髓衰竭
患者由白血病前期進入急性白血病期常呈現典型的骨髓衰竭表現。臨床表現為病情明顯加重且進展迅速治療效果差如不積極治療患者可短期死亡由於嚴重的骨髓衰竭出現貧血、出血以及發熱感染等症狀,表現乏力頭暈、心慌、呼吸困難;皮膚淤點淤斑、牙齦出血、口腔血泡、鼻出血血尿、便血少見嚴重者可因顱內出血迅速死亡;感染常見,可有低熱或高熱部分患者可有明確的局部感染病灶還有部分患者無明顯感染部位感染嚴重者,可出現感染性休克敗血症、膿毒血症等表現是繼發性白血病的常見死亡原因。僅5%患者有肝脾、淋巴結腫大。
併發症
1.感染、發熱 主要見於肺部感染,敗血症感染中毒性休克
2.出血 皮膚黏膜出血、腦出血。
特點
繼發性白血病的特點:
②白血病前期細胞或白血病細胞出現特殊的染色體異常;
③發展為白血病後生存期短,治療效果差由於這類疾病的發生多有明確的抗腫瘤藥物使用(如烷化劑等)和放療史因此又稱為治療相關骨髓增生異常綜合徵/急性髓系白血病(t-MDS/AML)大多數繼發性白血病都有MDS過程實際上繼發性MDS(secondary-MDS,S-MDS)和繼發性白血病是同一疾病的不同階段劃分的界限是骨髓中原始粒細胞+早幼粒細胞<30%者稱為MDS≥30%則為繼發性白血病。
病因
越來越多的研究證明,繼發性白血病的發生與原發病治療方案、原發病的類型、疾病的持續時間密切相關。繼發性急性髓系白血病(secondary acute myelocytic leukemia,SAML)發生的危險性取決於治療方案:①化療(伴或不伴放療)危險性高,單獨放療危險性最低;②全身照射比大劑量局部照射的危險性高;③患者或實驗動物接受治療的強度與白血病發生的危險度之間存在正相關繼發性白血病發生的危險程度與原發病類型的關係尚無法估計,有報導主要原發病類型為:①血液病:包括霍奇金病(HD)、多發性骨髓瘤(MM)非霍奇金淋巴瘤(NHL)急性淋巴細胞白血病(ALL)急性早幼粒細胞白血病(APL)和骨髓增殖性疾病等,也包括上述疾病造血幹細胞移植後;②非血液病:乳腺癌卵巢癌睪丸癌等。繼發性白血病病因與以下因素有關。 血液檢查指數
血液檢查指數
 血液檢查指數
血液檢查指數電離輻射
電離輻射(ionizing radiation)有明確增加人類及實驗動物發生AML的危險性。廣島核爆炸產生的400cGy以下的核輻射導致白血病發生率大約為2例/(106人·年·kg)而接受300~1500cGy脊髓照射的強直性脊柱炎患者白血病發生率與之相同;從事臨床放射職業人員和接受放射治療患者的流行病調查以及小劑量慢性照射在實驗動物可致白血病的結果表明放療與繼發性白血病發生關係直接而密切。最近,關於霍奇金病的研究表明,接受單純放療的患者比接受單純化療的繼發性白血病發生率低;大劑量局部放療比全身放療所致繼發性白血病發生率低得多;大劑量放療比小劑量多次放療致繼發性白血病發生率低後者已被小劑量慢性照射實驗動物致繼發性白血病的實驗結果所證實大劑量照射對骨髓細胞有致死作用而小劑量照射更易導致非致死性骨髓損傷及突變發生。
化療藥物
(1)烷化劑:包括氮芥(nitrogenmus-tards)、苯丁酸氮芥(瘤可寧)、環磷醯胺美法侖(馬法蘭)白消安、丙卡巴肼(甲基苄肼)、亞硝脲類烷化劑如卡莫司汀(BCNU)洛莫司汀(CCNU)司莫司汀(MeCCNu)等烷化劑是最強的致白血病藥物,其致白血病發生的機制是以不同方式作用於DNA導致DNA複製停止基因突變、染色體丟失同時,導致部分細胞死亡。85%的繼發性白血病患者曾接受烷化劑的治療各種烷化劑引起繼發性白血病的發生率各異其中65%的繼發性白血病患者接受過環磷醯胺、美法侖苯丁酸氮芥的治療。研究表明美法侖致白血病作用可能比環磷醯胺強這說明烷化劑之間致突變作用存在差異。
(2)拓撲異構酶Ⅱ抑制劑:
①鬼臼毒素類藥物:最具代表的依託泊苷(Etoposide,VP16)和替尼泊苷(Teni-poside,VM26)鬼臼毒素類是一類非插入性的DNA拓撲異構酶Ⅱ(TopoⅡ)的強抑制劑,它作用於TopoⅡ使TopoⅡ與DNA以共價鍵結合形成穩定的“藥物-酶-DNA”三元複合物阻礙TopoⅡ對DNA雙鏈再連線,導致DNA缺失和重排染色體斷裂和姐妹染色單體交換。實驗證明VP-16致繼發性白血病缺乏劑量依賴性和劑量累積的依據,白血病的發生與治療方案選擇以及患者自身因素與藥物的相互作用所致的可能性更大。
②蒽環類藥物:如阿黴素表柔比星(表阿黴素)、米托蒽醌和阿克拉黴素等,這類藥物通過形成穩定的拓撲異構酶Ⅱ-DNA複合體抑制DNA修復導致DNA單鏈和雙鏈的斷裂,阻止DNA和RNA的合成。它們是治療ALL、NHL、睪丸癌的主要藥物,常需聯合套用烷化劑或放射治療,因此,尚不能明確蒽環類藥物單獨套用是否致繼發性白血病發生近幾年來隨著急性早幼粒細胞白血病(APL)治療成功APL治療後繼發性白血病病例已報導10餘例,考慮與使用蒽環類和VP-16等藥物有關。
其他藥物
乙雙嗎啉和Razoxane這兩種藥物屬於免疫抑制劑,能抑制DNA的合成容易引發白血病長期套用發現其致白血病作用國內已報導多例。
非治療性物質
包括苯及苯的衍生物、汽油有機溶劑殺蟲劑、染髮劑、砷劑塗料等,長期接觸苯的人群繼發性白血病的發生率比對照組高出20倍中位發病時間9.7年其中發生急性白血病前6個月~6年有全血細胞減少。
發病機制
繼發性白血病的發病機制尚未闡明,許多研究證明多重作用導致繼發性白血病的發生和發展。
1.DNA序列及DNA調控異常 所有烷化劑和電離輻射是強致突變劑,它們的致突變作用可能與其致癌性及細胞毒作用有關。研究證明:繼發性白血病累及許多基因,癌基因激活或抑癌基因失活及抑制凋亡是白血病發生的重要機制由於DNA的遺傳信息改變導致白血病發生的危險性增加它們可引起許多類型的染色體異常,包括染色體斷裂複雜重排染色體部分或全部丟失由於化學致癌劑和放射線的作用,使位於染色體可遺傳變異區的癌基因表達增加,通過DNA點突變和DNA修飾或通過染色體的重排,從而改變細胞癌基因調控使造血幹細胞染色體斷裂或重排,產生異常的功能蛋白質如ras,myc和c-fms等。許多t-MDS/AML患者存在不平衡染色體改變可使染色體部分或全部丟失事實證明在丟失區可能存在某種抑癌基因。拓撲異構酶Ⅱ抑制劑所致的t-MDS/AML中常累及21號染色體轉錄因子CBFα2(AMlL-1),此處最易出現易位並累及8、12、3號染色體MLL(myeloid-lymphoid leukemia)基因是調節果蠅trithorax基因,與人類同源的基因MLL基因在控制早期造血幹細胞分化上起著重要作用。業已證實累及11q23染色體易位有20餘種如VP16誘導帶有MLL基因的t(9;11)易位,產生的新的融合基因直接引起明顯的生長失控和白血病發生具體比較見表1。
2.遺傳易感性 通過對高發白血病傾向的遺傳性疾病研究發現,這類患者對於紫外線和化學致癌劑(如烷化劑)的致突變作用十分敏感,這是由於其DNA修復功能缺陷如Fanconi貧血Bloom綜合徵及Kostmann粒細胞缺乏症。這類疾病易發生白血病的可能原因是存在某個與白血病遺傳易感性有關基因雜合子如Li-Fraumeni綜合徵患者帶有p53腫瘤抑癌基因胚胎突變的雜合子這些患者的白血病發生率增加。
流行病學
繼發性白血病的發生率明顯上升其發生率占白血病10%~20%,其中AML占90%~95%,ALL占5%~10%化療和 (或)放療所致繼發性白血病的中位潛伏期為4~5年治療後24~60個月危險最大治療10年後很少發生。由於繼發性白血病對治療反應差,是目前最可怕的腫瘤之一。
診斷
根據原發病用藥史放射史、職業接觸史、臨床表現血象及骨髓象特點,診斷一般不難。
鑑別診斷:
在診斷繼發性白血病時還應與以下疾病相鑑別。
1.原發性急性白血病 起病急通常無明顯的白血病前期表現貧血、感染、出血及組織器官浸潤染色體異常少見初治化療敏感緩解率高鑑別要點。
2.原發性MDS 原發性MDS通常無原發病及用藥史和放療史繼發性MDS三系增生明顯異常,以RAEB多見,治療效果差
3.巨幼細胞性貧血 有時與繼發性MDS相混淆,但前者骨髓中原始細胞不增多,幼紅細胞的PAS染色呈陰性無繼發性致白血病因素存在。
檢查
實驗室檢查
1.血象
(1)白血病前期:此期的突出表現為三系無效造血,全血細胞少大多數患者表現紅細胞生成減少,血紅蛋白(Hb)和紅細胞(RBC)計數下降MCV增加,網織紅細胞計數降低,外周血出現橢圓形巨紅細胞和有核紅細胞,此為繼發性白血病最早的血液學變化。MCV增高與霍奇金病(HD)高危發生繼發性白血病相關,MCV增高組比對照組發生繼發性白血病早3~4年。75%患者有輕度的中性粒細胞減少可有胞質顆粒減少和假Pelger-Hǔet異常,可有單核細胞增多嗜鹼粒細胞增多60%患者有血小板減少,可見無顆粒血小板、巨大血小板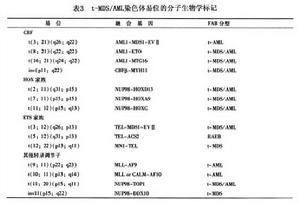 染色體檢查
染色體檢查
 染色體檢查
染色體檢查2.骨髓象
(1)白血病前期:該期的骨髓形態學的特徵之一是三系細胞異常增生,以紅系增生更為明顯其次難以用FAB分型來診斷t-MDS若以FAB分型對t-MDS進行標準分型,診斷為RAEB的患者明顯高於原發性MDS。1/3~1/2的患者骨髓增生明顯或極度活躍,1/3的患者為增生減低少數患者的骨髓增生程度正常;紅系異常增生包括紅細胞巨幼樣變,環形鐵粒幼細胞數量增加,偶可見環形鐵粒幼細胞為主,原始紅細胞數量增加出現核出芽核碎裂和雙核紅細胞胞質染色不均勻多嗜性或點彩紅細胞、豪-周小體易見;粒細胞系可見胞質顆粒增多過少或無核分葉過少或過多或不分葉出現Pelger-Hǔet樣異常,幼稚粒細胞比例增加;巨核細胞系可見小巨核細胞巨核細胞顆粒減少幼稚巨核細胞數量可增加。在此期可出現不同程度的骨髓纖維化
(2)急性白血病期:骨髓增生程度同t-MDS,三系細胞出現明顯的病態造血,原始細胞增多≥30%Auer小體很少見,原始粒細胞增多,為M1M2常由烷化劑所致;原始單核細胞增多為M4M5常由拓撲異構酶Ⅱ抑制劑所致前者發生率多於後者t-AML常很難利用FAB分型標準分型常有兩種或兩種以上的形態學改變。t-ALLt-CML、t-APL骨髓象同原發性白血病改變。
3.細胞化學
(1)中性粒細胞鹼性磷酸酶(NAP) NAP陽性率減低,積分降低。
(2)過氧化物酶(POX) t-AML患者該酶陽性率減低,繼發性白血病為10%,原發白血病可達100%。
(3)氯醋酸 AS-D萘酚酯酶20% t-AML的患者該酶陽性陽性率低於原發性
AML後者達47%
4.染色體檢查 通過染色體G帶染色及姐妹染色體交換等技術可檢測到。76%~90%繼發性白血病患者原始細胞存在克隆性染色體異常,而原發性AML僅有48%~66%,原發性MDS為38%~60%。繼發性白血病的複合染色體異常為75%,高於原發性AML(45%)和MDS(25%)49%的繼發性白血病患者有異常核型(AA),36%的患者為正常核型與異常核型嵌合體(AN),15%的患者為正常核型(NN)在染色體數目異常中常為亞二倍體染色體,超二倍體少見而原發性AML多為二倍體或超二倍體烷化劑使用後的繼發性白血病多出現複合染色體異常最常見為-5/5q-,-7/7q-繼發於拓撲異構酶Ⅱ抑制劑的繼發性白血病最易累及11q23或2lq22,致染色體易位。繼發性白血病的細胞遺傳學異常。
5.分子生物學檢查 染色體易位實質是形成特定的融合基因多累及核結合因子(CBF)HOX家族成員ETS家族成員和其他轉錄調節因子,其結果出現新轉錄因子或轉錄因子受體,導致異常的分化增殖和凋亡。t-MDS/AML染色體易位見表3
6.原始細胞的體外培養 繼發性白血病患者的原始細胞培養示CFU-GM集落生成減少或不生成而集簇數目增多,與原發性白血病患者相似,認為白血病前期的髓系集落形成率降低具有診斷和預後意義,但對臨床治療價值有限。
其它輔助檢查
治療
無論何時診斷t-MDS/AML,治療將是一個非常棘手的問題儘管新的細胞生長因子和新的化療藥物使用治療結果仍不理想總的來說t-MDS/AML總體效果和預後較原發性MDS/AML差。Visai等報導根據患者的不同預後來選擇治療方案可將繼發性白血病的預後分為三型:①療效好組:M3型伴有t(8;21)或inv(16)染色體異常;②療效中等組:繼發於ALL治療和拓撲異構酶Ⅱ抑制劑;③療效差組:伴5號或7號染色體異常和繼發於MDS者。針對不同的預後,提出治療方案如下:①預後好組:採用單純化療;②預後中等組:採用標準劑量/大劑量化療+造血幹細胞移植;③預後差組:若年齡>65歲,給予支持治療,年齡<65歲,採用標準劑量/大劑量化療+支持治療。
支持治療
(1)成分輸血:成分輸血的目的是改善臨床症狀,貧血患者輸注濃縮紅細胞使其血紅蛋白維持在80g/L以上。但反覆輸注濃縮紅細胞可使體內鐵負荷過重甚至導致繼發性血色病的發生最終因器官功能衰竭死亡。因此,對此類患者應定期測定血清鐵,運鐵蛋白飽和度和鐵蛋白含量。若鐵負荷過多應給予鐵螯合劑治療,加速體內鐵的排泄,減輕對心、肝、胰等重要器官的損害。常用去鐵胺(Deferomamine)治療1.5g/d,每周治療5天緩慢皮下注射,直至鐵負荷降至正常停用。此外,還可使用鐵螯合劑口服。對於血小板持續減少PLT<20×109/L伴有出血的患者,給予濃縮血小板懸液輸注可有效止血但長期輸注後,易使患者體內產生抗血小板相關抗體,使輸注的血小板迅速破壞,引起血小板無效輸注目前建議輸注來自單一供體的血小板濃縮物因為前者比隨機多供體的血小板濃縮物能明顯降低同種免疫反應的發生率。
(2)預防感染:感染是繼發性白血病患者常見併發症也是致死的主要原因因此,預防感染甚為重要。適當給予小劑量免疫球蛋白製劑是必要的常用靜脈免疫球蛋白針劑5~10g/d用5~10天儘量減少糖皮質激素的套用不採用白細胞輸注若發生感染,則按急性白血病的抗感染策略進行治療。
(3)葉酸:因繼發性白血病常常出現巨幼細胞貧血的形態學特徵,非葉酸缺乏,補充葉酸是無效的可用葉酸試驗性治療以鑑別是否有葉酸缺乏。劑量:10mg/次3次/d口服,無明顯不良反應。
(4)維生素B6:有人試用大劑量的維生素B650~200mg/d分次口服結果證明部分患者僅有網織紅細胞升高,輸血次數減少但對病態造血無影響。
誘導分化劑
(1)維A酸:
①異維A酸(13-順式維甲酸):體外研究證明13cisRA抑制急性早幼粒細胞白血病(APL)患者的白血病細胞增殖誘導白血病細胞分化。該藥在繼發性白血病的初期臨床治療中結果令人鼓舞,但隨機研究未能取得較好的反應率,認為該藥療效不肯定劑量:2~4mg/(kg·d)或20~125mg/(m2·d),療程1~11個月,通常口服至少3個月以上。不良反應有肝損害(ALT、AST增高膽紅素增高)口唇乾裂皮膚過度角化口腔炎血清三醯甘油增高等。不良反應與劑量有關劑量在100mg/m2之內可減少不良反應。
②維A酸(全反式維甲酸):維A酸(ATRA)是一種新的維生素A衍生物對APL及HL-60細胞系有誘導分化作用,但對絕大多數繼發性白血病無效。劑量:20~30mg/d口服,至少用藥3個月,療程1~9個月不良反應:口乾唇乾皮膚過度角化,關節酸痛肌肉痛,ALT增加膽紅素升高,劑量過大可出現維A酸綜合徵
(2)維生素D3及其衍生物:通過與細胞內的特異性維生素D3受體(VDR)結合調節DNA複製和翻譯促進異常細胞分化用骨化三醇(羅鈣全)治療t-MDS患者未觀察到臨床反應劑量:2µg/d口服,連用4~20周。
(3)小劑量阿糖胞苷(Ara-C):LD-阿糖胞苷(Ara-C)的作用機制是細胞分化還是細胞毒作用尚有爭議目前認為兩種作用兼而有之。對繼發性白血病療效僅有較低的反應率(10%~25%)中位反應持續時間短,通常在3~15個月。一項關於LD-阿糖胞苷(Ara-C)治療的Meta分析顯示,170名患者中27名(16%)獲得CR中位反應期10.5個月,但未能延長生存期劑量:10~20mg/(m2·d)連用21天為一療程,有效可繼續用,也有主張在緩解後每月維持4天,維持數月。不良反應:骨髓抑制,口腔黏膜炎。
(4)地西他濱(5-氮雜-2,脫氧胞苷):地西他濱(DAC)能抑制DNA甲基轉移酶,降低DNA甲基化抑制集落生長,誘導異常細胞分化體外實驗證明該藥是有細胞毒作用的,因此,可能同時導致異常克隆的產生一項研究中43例MDS患者接受地西他濱(DAC)治療7例為t-MDS患者總反應率為49%CR率為12%總體中位生存期為13.3個月。劑量:45mg/(m2·d),連用3天為1療程5~7周重複1療程不良反應:骨髓抑制,胃腸道症狀,肝功能損害。
(5)誘導分化劑聯合套用:可使用的方案有:①異維A酸(13cisRA )60mg(m2·d)+阿糖胞苷(Ara-C) 5mg/(m2·d),每12 h一次,皮下注射;②異維A酸(13cisRA)1mg/(kg·d)+INF-α3×106U/d+維生素D31μg/d;③維A酸(ATRA) 45mg/(m2·d),第1~12周+G-CSF 5μg/(kg·d)第5~12周;④異維A酸(13cisRA) 2mg/(m2·d)+維生素D3 0.75μg/d連用21天+阿糖胞苷(Ara-C)10mg/m2 每12小時1次連用15天。
刺激骨髓造血藥物
(1)雄激素:睪酮刺激紅細胞生成的作用機制是驅使G0期的CFU-S進入增殖周期,加強了幹細胞增殖與分化的作用,刺激紅細胞生成素產生。以達那唑(Danazol)研究較多劑量為600mg/d分次口服,治療時間至少在3個月以上,絕大多數病例顯示無效。不良反應:肝功能損害。
(2)腎上腺皮質激素:文獻報導用大劑量甲潑尼龍治療t-MDS1g/d連用3天結果無效部分患者可誘發感染
細胞因子
隨著細胞生物學和分子生物學的進展。越來越多造血因子可通過基因工程的方法大批量生產並進入臨床套用從理論上講造血因子可加速骨髓中殘存的正常祖細胞增殖分化誘導MDS細胞分化使之轉為正常的造血細胞,促進強烈化療後患者造血功能的恢復改善患者全血細胞減少但治療結果顯示,三系細胞恢復罕見且不能清除異常克隆目前已套用的細胞因子有以下幾種。
(1)紅細胞生成素(EPO):EPO體外試驗可促進MDS患者紅系祖細胞的增殖,呈劑量依賴性在100U/ml最強。EPO水平低於500U/ml的患者若接受rhEPO治療將有10%~20%患者貧血改善;若聯合G-CSF治療,則大多數患者紅細胞計數改善,但不影響無病生存期劑量:50~100μg/kg3~5次/周,至少用藥12周以上不良反應:水鈉瀦留高血壓等。
(2)粒/粒-單核細胞集落刺激因子(G-CSF/莫拉司亭(GM-CSF):大部分繼發性白血病患者CFU-GM減低體外試驗證明,G-CSF莫拉司亭(GM-CSF)促進大多數繼發性白血病患者的粒單祖細胞的增殖促進中性粒細胞成熟增強中性粒細胞功能且能抑制惡性克隆增生,但有時可使原始細胞數量增加。劑量為120μg/(m2·d)皮下注射持續2周間歇2周;也可從小劑量開始0.1μg/(kg·d),皮下注射,每2周增加劑量1次逐漸增至3μg/(kg·d),連用6~8周不良反應為肌肉關節疼痛和毛細血管漏出綜合徵,包括水腫、心包積液胸腔積液等,少數有過敏現象如顏面潮紅、心動過速呼吸困難、寒戰甚至暈厥也有極少數出現骨髓纖維化。
(3)白細胞介素3(IL-3):IL-3能刺激造血幹細胞增殖在不同程度上促進紅系粒單系巨核系及淋巴系祖細胞增殖,尤其對巨核細胞有較大作用。劑量為250~500g/(m2·d),皮下注射,15天為1療程不良反應:發熱頭痛骨痛及頸項疼痛等。
(4)干擾素(IFN):干擾素α和干擾素γ均試用於繼發性白血病,目前沒有觀察到明顯的作用理論講干擾素可刺激原始粒細胞的成熟及向單核細胞分化,使細胞內癌基因c-myc表達下降逆轉細胞的惡性表型劑量為(2~5)×106U/(m2·d)至少套用6個月以上最好長期用藥不良反應為發熱流感樣症狀血小板減少等
聯合化療
文獻報導強烈聯合化療治療繼發性白血病比LD-阿糖胞苷(Ara-C)和5-Aza有更高的CR率644例患者採用標準的誘導化療方案,182例(28%)達到CR在一系列小樣本研究中,已取得了30%~70%CR率。在誘導緩解階段這些方案伴隨著明顯化療不良反應的發生和15%~30%的死亡率年輕的患者和預後好的患者有較高的CR率和較長的持續CR時間。Kantrjian報導63例MDS採用不同強烈化療方案,其CR率為64%,誘導緩解期死亡率為19%中位CR時間為10個月2年的無病生存率為25%其中有13例為t-MDS其CR率低於原發性MDS(31%對68%)而且5和7號染色體異常的患者對化療反應性差。
繼發性白血病化療的結果取決於原發的腫瘤、預先存在MDS染色體異常、年齡和機體狀態。許多報導顯示大劑量阿糖胞苷(Ara-C)[HD-阿糖胞苷(Ara-C)]有高的CR率但持續緩解期短。HD-阿糖胞苷(Ara-)C或ID-阿糖胞苷(Ara-C)分別聯合卡鉑、去甲氧柔紅黴素和依託泊苷的強烈誘導化療結果。
造血幹細胞移植(HSCT)
異基因骨髓移植(Allo-BMT)是繼發性白血病患者獲得長期存活的惟一希望文獻報導患者年齡<60歲有HLA配型相合的供體可考慮Allo-BMT,年輕患者可考慮無關供體異基骨髓移植和單倍體親緣間骨髓移植資料顯示它們治療效果與原發性MDS/AML無差異相反,另一組資料比較了原發性MDS/AML與繼發性白血病的Allo-HSCF移植後5年DFS為34.5%和7.8%,復發率24%和43%,無復發相關死亡率(NRM)為41.9%和49%,認為繼發性白血病的結果比原發性MDS/AML差其主要原因是:NRM羅馬會議上報導89例患者接受HSCT移植,81例患者死亡28例死於復發18例死於感染17例死於器官功能衰竭7例死於GVHD4例死於中樞神經系統出血4例原因不明3例死於繼發性腫瘤Kaplan-meier復發率在3.1年達28.6%Kaplan-meier生存率在6.4年處於平台期達12%自體骨髓移植(ABMT)套用仍存在著體外淨化和移植後復發率較高的問題。自體外周血幹細胞移植(APB-SCT)發展較快將骨髓中造血幹細胞動員到外周血中,以採集到足夠數量的外周血造血幹細胞(PBSC)以保證移植後造血恢復,大多數學者認為有HLA配型相合的供者的年輕患者應首先考慮異基因骨髓移植繼發性白血病骨髓移植結果。
預後
t-MDS預後並不比t-AML好因為50%以上t-MDS很快轉變為t-AML因此繼發性白血病預後極差,自然病程3~6個月。經現代治療,疾病可部分緩解,但緩解持續時間短,無病生存亦短。預後因素有:①年齡:年齡越大越差。②亞型:M3及拓撲異構酶Ⅱ抑制劑引起的M4、M5預後好。③染色體核型:t(8;21)或inv(16)染色體好而-5-7或5q-7q-者差。④原發疾病:繼發於兒童ALL的預後相對較好,而繼發於MDS則預後差。
預防
強烈化療和放療延長了ALL、淋巴瘤骨髓瘤、睪丸癌、卵巢癌的生存期輔助化療經常用於近期診斷的僅有腋窩淋巴結轉移的乳腺癌患者和其他對化療敏感的腫瘤患者的術前和術後治療在這些患者中,大劑量化療或放療後給予造血幹細胞支持治療的套用越來越多,治療後生存期延長,因而,繼發性白血病的發生率可能會相應地增加。這些治療雖然明顯改善了腫瘤患者的生存率和生活質量但對繼發性白血病發生的危險性估計應成為制定總體治療方案的一部分,對有致白血病作用的治療方案應予充分的考慮當治療某一疾病時若療效相當致白血病弱的藥物應取代烷化劑;當患者原發病復發的風險較低時,輔助性化療的選擇應慎重,儘量不用烷化劑類藥物。有幾種在兒童期已出現基因突變易於發展為繼發性白血病的疾病如唐氏綜合徵先天性免疫缺陷綜合徵范科尼貧血和神經纖維母細胞瘤烷化劑亞硝脲類烷化劑鬼臼毒素類藥物不能套用應選用抗代謝藥物。烷化劑在真性紅細胞增多症的使用應慎重最好套用羥基脲治療HD時ABVD更優於MOPP,環磷醯胺比其他烷化劑有更小的致白血病性所有的烷化劑和鬼臼毒素類藥物對非惡性疾病的套用應極為慎重。

