基本介紹
- 中文名:絕熱可逆過程
- 外文名:Adiabatic reversible process
- 對象:理想氣體
- 方程使用條件:理想氣體、絕熱、可逆
- 求解:知P、V、T中任何一個就可求解
- 套用領域:物理化學
簡介
絕熱過程
基本公式


可逆絕熱過程方程
使用條件


具體方程式




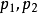
功能
典例
例1
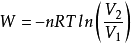



例2

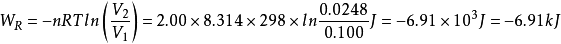
例3


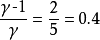
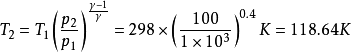



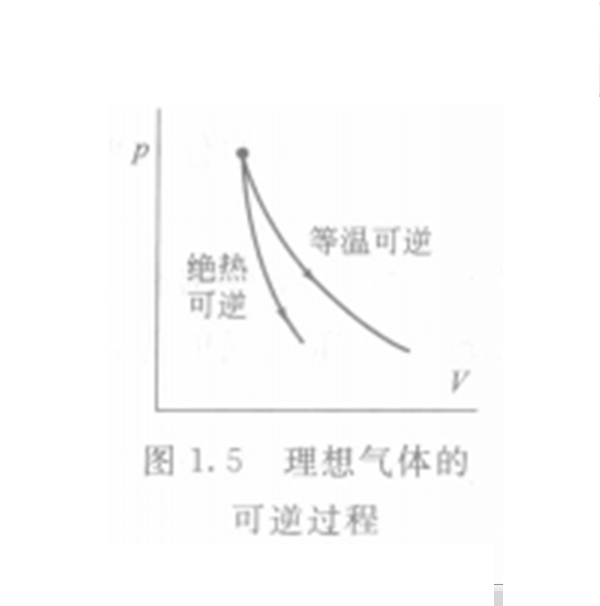








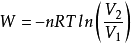




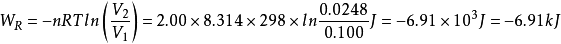


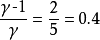
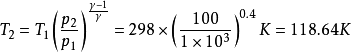



關於理想氣體,有可逆絕熱過程方程,在滿足理想氣體、絕熱、可逆這三個基本條件,才能使用該方程。從理想氣體的絕熱可逆方程可以看出:理想氣體在絕熱可逆過程中的任意某...
絕熱可逆過程:就是體系沒有熱量的散失,且該反映是可逆的過程。可逆的絕熱過程是等熵過程。等熵過程的對立面是等溫過程,在等溫過程中,最大限度的熱量被轉移到了...
絕熱過程是一個絕熱體系的變化過程,即體系與環境之間無熱量交換的過程。...... 由絕熱過程方程可知,絕熱過程在p-v圖中是一條高次雙曲線,而可逆絕熱過程為定熵過...
=0,即熵不變,所以可逆絕熱過程即等熵過程。 [2] 絕熱方程等溫過程 編輯 系統的溫度始終保持不變的過程。等溫過程的特點是溫度T=恆量。對理想氣體而言,在等溫的...
可逆過程是指熱力學系統在狀態變化時經歷的一種理想過程。熱力學系統由某一狀態出發,經過某一過程到達另一狀態後,如果存在另一過程,它能使系統和外界完全復原,既使...
根據熱力學第二定律,在可逆的絕熱過程中,系統的熵不變。用良好絕熱材料隔絕的系統中進行的過程,或由於過程進行得太快,來不及與外界有顯著熱量交換的過程,都可...
絕熱壓縮性也稱“定熵壓縮係數”。簡單可壓縮系統在定熵過程中比容隨壓力的變化率與比容的比值。是表示物質系統在可逆絕熱條件下相對壓縮性的常用熱係數之一。...
亦稱“定熵壓縮係數”。簡單可壓縮系統在定熵過程中比容隨壓力的變化率與比容的比值。是表示物質系統在可逆絕熱條件下相對壓縮性的常用熱係數之一。...
絕熱系統是指不與外界發生熱量交換的熱力學系統,但其可以與外界發生物質交換、功交換。這種系統中的熱力學過程是絕熱過程。絕熱系統是熱力學中為便於分析和計算而...
熱力學系統始終不與外界交換熱量, 即dQ =0 的過程。根據熱力學第一定律,在絕熱過程中,系統對外所作的功等於內能的減少量。根據熱力學第二定律,在可逆的絕熱過程...
絕熱節流節流 管道中的流體流過截面突然縮小的閥門、狹縫及孔口等部分後發生壓力降低的現象,稱為節流。節流過程是一種典型的不可逆過程。...
絕熱指數是指理想氣體可逆絕熱過程的指數,用K表示,所以理想氣體比熱比等於絕熱指數。在天體物理學中絕熱指數也指天體被壓縮1%所產生的壓力增大的百分比。...
熱力學過程 結在一起。 在過程中,系統的淨能量沒有因為加熱或冷卻而有所改變,稱為絕熱過程。對於一個可逆的過程,這與等熵過程一樣。我們可說這個系統因為一個...
等溫過程是熱力學中一種重要過程。卡諾循環就是由兩個等溫過程和兩個絕熱過程組成的。物質三態的可逆轉變也是在等溫條件下進行的。 [4] ...
這些都是熱力學中分析計算熱力過程和熱力循環所必需的。對於單位質量的理想氣體,可逆的典型熱力過程有定容過程、定壓過程、定溫過程、絕熱過程和多變過程。...
定溫過程是熱力學中一種重要過程。卡諾循環就是由兩個定溫過程和兩個絕熱過程組成的。物質三態的可逆轉變也是在定溫條件下進行的。...
