絕熱方程是利用熱力學第一定律和理想氣體狀態方程在準靜態條件下導出的,絕熱方程的套用必須滿足理想氣體條件和準靜態條件。
基本介紹
- 中文名:絕熱方程
- 外文名:adiabatic equation
- 學科:熱力工程
- 反應:度與氣壓之間變化規律
- 對象:理想氣體
- 類屬:公式
公式介紹
絕熱過程
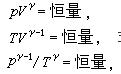

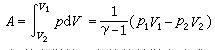



等溫過程
絕熱過程方程導出模擬

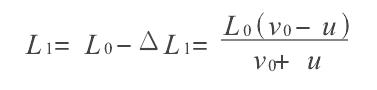
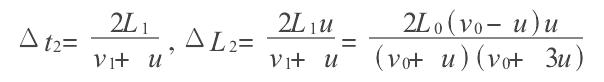
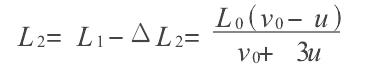
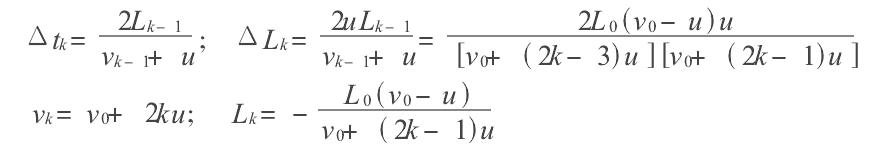




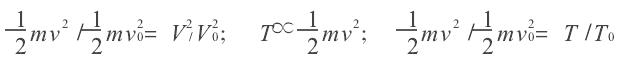
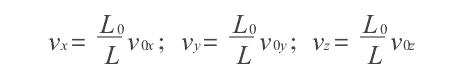
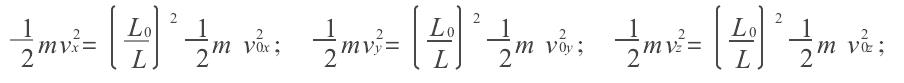
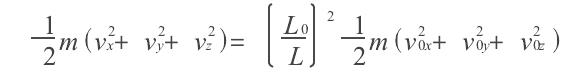
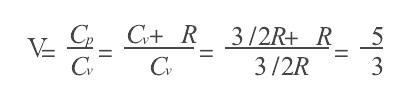

絕熱方程是利用熱力學第一定律和理想氣體狀態方程在準靜態條件下導出的,絕熱方程的套用必須滿足理想氣體條件和準靜態條件。
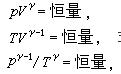

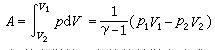




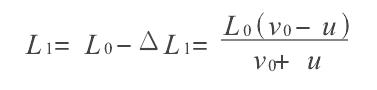
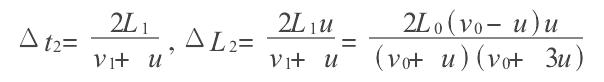
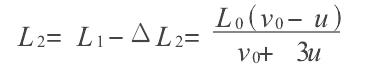
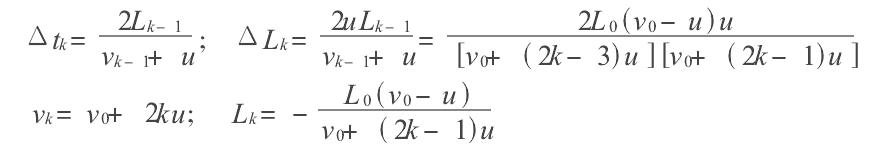




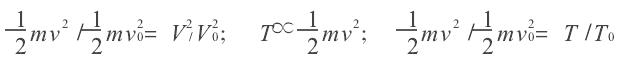
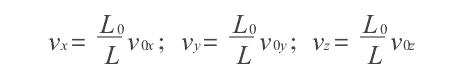
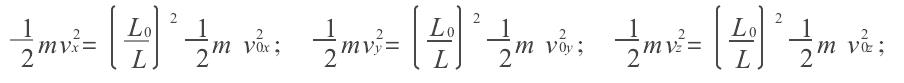
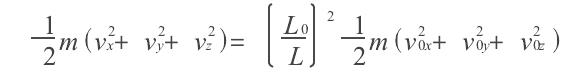
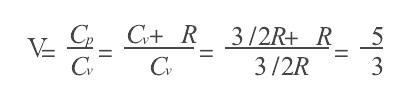
絕熱方程是利用熱力學第一定律和理想氣體狀態方程在準靜態條件下導出的,絕熱方程的套用必須滿足理想氣體條件和準靜態條件。...
絕熱過程是一個絕熱體系的變化過程,即體系與環境之間無熱量交換的過程。...... 絕熱過程是一個絕熱體系的變化過程,即體系與環境之間無熱量交換的過程。...
一個物體的邊界如果沒有任何形式的傳熱方式,則被定義為絕熱。在工業生產中設備的良好絕熱性可以大大減少能量的損耗,提高生產效益。根據絕熱的理論對材料的熱損失性能...
絕熱壓縮性也稱“定熵壓縮係數”。簡單可壓縮系統在定熵過程中比容隨壓力的變化率與比容的比值。是表示物質系統在可逆絕熱條件下相對壓縮性的常用熱係數之一。...
關於理想氣體,有可逆絕熱過程方程,在滿足理想氣體、絕熱、可逆這三個基本條件,才能使用該方程。從理想氣體的絕熱可逆方程可以看出:理想氣體在絕熱可逆過程中的任意某...
絕熱反應過程adiabatic reaction process是反應系統與外界沒有熱交換的過程。對於放熱反應,反應系統溫度上升所需的熱量來源於全部的反應熱;吸熱反應所需要的反應熱來源...
絕熱常數,即絕熱指數(英語:adiabatic index)是指等壓熱容和等容(等體積)熱容的比值,也稱為熱容比(英語:heat capacity ratio)、比熱比(英語:specific heat ratio)...
絕熱可逆過程:就是體系沒有熱量的散失,且該反映是可逆的過程。可逆的絕熱過程是等熵過程。等熵過程的對立面是等溫過程,在等溫過程中,最大限度的熱量被轉移到了...
絕熱指數是指理想氣體可逆絕熱過程的指數,用K表示,所以理想氣體比熱比等於絕熱指數。在天體物理學中絕熱指數也指天體被壓縮1%所產生的壓力增大的百分比。...
亦稱“定熵壓縮係數”。簡單可壓縮系統在定熵過程中比容隨壓力的變化率與比容的比值。是表示物質系統在可逆絕熱條件下相對壓縮性的常用熱係數之一。...
絕熱功(adiabatic work),指系統在絕熱過程所做的功。...... 絕熱功(adiabatic work),指系統在絕熱過程所做的功。中文名 絕熱功 外文名 adiabatic work 解釋 ...
絕熱方法是利用物質系統在與外界沒有熱交換的情況下所發生的物理過程來提高熱機效率或達到其他相關目的的方法。卡諾熱機是十九世紀初由卡諾提出的熱效率最高的熱機。...
絕熱條件是指體系與外界無熱交換的條件,也就是外界熱量無法進入體系,體系的熱量也無法向外擴散的條件,是一種理想化的條件。...
絕熱系統是指不與外界發生熱量交換的熱力學系統,但其可以與外界發生物質交換、功交換。這種系統中的熱力學過程是絕熱過程。絕熱系統是熱力學中為便於分析和計算而...
不可逆絕熱過程是指熱力學系統在狀態變化時經歷的一種理想過程。熱力學系統由某一狀態出發,經過某一過程到達另一狀態後,如果無論採用何種辦法都不能使系統和外界...
分析大氣熱力狀態以及對某些熱力過程進行計算,利用圖解法要簡便的多。這不僅在時間上經濟,而且用圖解分析既直觀又清晰。 由於大氣熱力學圖解主要是用於描述大氣的絕熱...
絕熱近似,又稱絕熱逼近、絕熱定理,是由麥克斯·玻恩(Max Born)和弗拉基米爾·福克(Vladimir Fock)在 1928 年提出的量子力學概念:如果某種微擾足夠緩慢地作用於一個...
氣體在絕熱流動過程中,因受到某種物體的阻礙而流速降低為零的過程稱為絕熱滯止過程。 ...
節流過程中氣流與外界的熱交換可以忽略不計時,可以認為節流過程為絕熱過程,稱為絕熱節流。氣體絕熱節流的特徵:(1)忽略略氣體流動動能的變化,絕熱節流前後焓值相等...
