名稱由來 章魚胺最早是1951由前蘇聯科學家Espamer和Boretti在真蛸(Octopus vulgaris,章魚的一種)的唾液腺體中發現而得名,後來相繼發現它大量分布於各種無脊椎動物如節肢動物、軟體動物等的各種組織中。OA在昆蟲的中央神經系統(CNS)中含量最高,在支配所有主要神經纖維的神經元中均含有一定濃度的OA。
作用 它是一種防治肥胖症和Ⅱ型糖尿病的β3-腎上腺素受體激動劑,對激活胰島素釋放敏感性而發揮作用;具有調節人體新陳代謝、保持血糖平衡、抑制食慾、提高注意力等特殊的藥理作用和生理功能,是在防治肥胖症和Ⅱ型糖尿病方面具有良好前景。另外,OA的存在及含量的變化對各種昆蟲的生長和行為具有顯著的生物效應。
據一些研究結果推測,OA極可能與保幼激素(JH)、前胸腺激素(PTTH)等物質有共同協助作用,它還可能影響保幼激素酯酶(JHE),並進而使JH含量產生變化;蛻皮激素含量也可能受OA的影響。OA受體是僅存在於無脊椎動物體中的非肽鍵型受體。以OA為先導化合物探索合成OA的激動劑或促進OA分泌的物質,有可能獲得控制昆蟲行為的目標分子。利用這個靶標來進行新型、高選擇性、安全的昆蟲調節劑的探索工作較為引人注目。已有4名諾貝爾獎獲得者(Axelrod J,Greengard P,HorvitzHR和KandelER)從事關於OA的研究。他們分別在章魚胺受體(octopamine receptors,OARs)識別、秀麗隱桿線蟲Caenorhabditis elegans體內章魚胺功能以及脊椎動物體內痕量生物胺(trace amine)探尋等相關領域開展研究(Nathanson and Greengard,1973;Saavedraetal.,1974;Evans,1981;Horvitzetal.,1982;Arakawaetal.,1990;Changet al.,2000)。
牛磺酸及章魚胺衍生物色譜圖 章魚胺是無脊椎動物神經系統中普遍存在的多種微量生物胺之一。雖然首先被發現存在於軟體動物章魚的唾液腺中,不過OA生理學意義的研究卻首先開展在脊椎動物和節肢動物體內。在脊椎動物神經系統中,OA被認為是“
痕量 生物胺”或是“虛假的”神經遞質。雖然有跡象表明OA是調節去甲腎上腺素突觸傳導的神經遞質,但是至今在哺乳動物的中樞神經系統(以下簡稱CNS)中沒有發現特異性的OA受體。OA的分布及含量變化對於昆蟲和一些軟體動物、蟎類等的生長、取食、代謝等多種生理和生物效應具有重要的作用。
功能 其主要功能是:
(1)神經遞質,可控制內分泌或光器官。所謂神經遞質是指存在於神經細胞與神經細胞的接合部、神經細胞與肌肉細胞的接合部等突觸部、由突觸前部釋放出並作用於突觸後部的一類傳遞神經信號的化學物質。神經遞質有許多不同類型,如乙醯膽鹼、γ-氨基丁酸、
生物胺 等;
(2)神經激素,可誘導脂類和碳水化合物的移動;
(3)神經修飾物質,可影響運動類型、棲息甚至記憶,還可作用於各種肌肉、脂肪體和感覺器官的末梢。同位素酶法、
HPLC -ECD(電化學檢測器)和GC/MS法為研究OA分布及含量變化的常用方法,而HPLC-UV法因靈敏度低而基本上不再被採納。
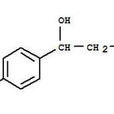
3種濃度的章魚胺標準溶液紫外光譜 生化性質 化學結構 章魚胺(octopamine,簡稱OA,別名:奧克巴胺、真蛸胺、羥苯乙醇胺、酚乙醇胺),化學名稱為: 1-(4-
羥基 苯基)-2 氨基乙醇。英文別名Benzylalcohol, a-(aminomethyl)-p-hydroxy-(6CI,8CI); (RS)-Octopamine; 1-(p-Hydroxyphenyl)-2-aminoethanol;2-Amino-1-(4-hydroxyphenyl)ethanol; 4-Hydroxyphenethanolamine;4-[2-Amino-1-hydroxyethyl]phenol; Analet; DL-Octopamine。
章魚胺結構式 是脊椎動物激素去甲腎上腺素的一個同類物,具有對-羥苯-β-羥乙胺的化學結構,分子式為C8H11NO2,分子量為153.176。熔點160℃,沸點360.7℃,閃點172℃。密度1.249g/cm3。
旋光度 [α]D25-37.4°(c=1、水)。腹腔-小鼠LD50:600 毫克/公斤,靜脈-小鼠LD50:75 毫克/公斤。摩爾折射率:42.75,摩爾體積(m3/mol):122.6,等張比容(90.2K):343.3,表面張力(dyne/cm):61.4,極化率(10-24cm3):16.95。
章魚胺在220nm的HPLC色譜圖 提取章魚胺工藝為:真蛸下腳料粉碎→稀釋漿液→固液分離→一級陶瓷膜微濾分離→二級卷式膜超濾分離→反滲透濃縮→大孔樹脂吸附純化→乙醇洗脫→真空冷凍乾燥→純化→天然章魚胺粉末。
體內含量及分布 由於受技術和設備限制,長期以來各國都用化學合成法生產的價格高昂的章魚胺(500元/克)。對章魚胺來源的研究多集中在中藥枳實和魚露上。但枳實中章魚胺的含量僅約為0.01%~0.03%,
魚露 中章魚胺的含量約為0.06%~0.1%,經檢測魚類、甲殼類、貝類以及頭足類中章魚胺含量較高,為0.1%~2.18%。
章魚胺衍生物 中國常見淡水魚的章魚胺含量在30~130μg·g-1之間。魚的種類不同,章魚胺含量也不相同。同是鯉科的魚類,其含量也不一樣,這種現象的產生是否與餌料有關,還需要進一步研究討論。就算是同一種魚,其背肉與腹肉也存在一定的差異,背肉的章魚胺含量普遍比腹肉高,像
鱸魚 ,背肉比腹肉的含量高4倍左右,而黑魚的背肉比腹肉的含量只高了一點點。海水魚魚肉中章魚胺含量海水魚肉的章魚胺含量與淡水魚肉未見明顯差異。淡水魚的背肉章魚胺含量普遍比腹肉高,但在海水魚中沒有規律性的變化。小黃魚、鰻鱺的背肉含量是腹肉的3倍左右,但銀鯧的背肉含量只占腹肉的二分之一。魚的腹肉中一般含有較多的脂肪,蛋白質相對較少。淡水甲殼類的章魚胺含量在12~200μg·g-1之間,這個含量與淡水以及海水魚沒有太大差異,但品種之間差異較大,以河蚌的章魚胺含量最大。為206μg·g-1,同樣是貝類,黃蜆的含量只有河蚌的六分之一。凡納對蝦是海水淡養的,含量為158μg·g-1,是日本沼蝦含量的10倍以上海水甲殼類等可食部章魚胺含量海洋甲殼類中章魚胺的明顯比海水魚、淡水魚以及淡水甲殼類中高几十倍,甚至千百倍。四角蛤蜊含量最低,也有2700μg·g-1,細角螺含量最高,達到了11000μg·g-1。
章魚胺含量圖冊參考文獻。
不同的學者曾經採用了不同的方法來研究節肢動物體內OA等生物胺的含量。Davenpor等運用同位素酶法分別研究了機械振盪及體溫升高前後美洲大蠊Periplaneta americana及蝗蟲Schistocerca americana血液中OA含量變化規律。Perriere等在利用HPLC-ECD測定了蜚蠊Blaberus craniifer神經系統(CNS)中OA、DA和5-HT等生物胺含量變化規律;Paula等用
膠束電動毛細管色譜 連電化學檢測器測定了果蠅Drosophila melanogaster體內OA,TA,DA和5-HT等生物胺的含量。Grosclaude等採用HPLC-ECD法研究線蟲Nippostrongylusbrasiliensis體內OA等生物胺的含量,檢測到了10.62ng/g組織的OA;Hiripi等用上述方法研究了蝸牛Lymnaea stagnalis和Helixpomatia體內OA分布及含量,從口神經節檢分別測到了12.6pmol/mg組織和18.8 pmol/mg組織的OA。Macfarlane等運用氣相色譜(GC)連線負離子化學電離質譜(NICIMS)測定蝗蟲Schistotercagregaria胸部OA等生物胺的含量,該方法缺乏特異性;Nusrat等運用上述方法研究了美洲大蠊Periplaneta americanaCNS中OA及其酸代謝物的含量,OA能達到100 pg的最低檢出限。Smart曾試圖利用氣相色譜-紫外(HPLC-UV)法研究線蟲Ascaridiagalli體內5-HT及其代謝規律,其靈敏度不高,只能達到μg/g水平。Meyer等用連螢光檢測器的液譜檢測了幾種有苯酚結構的物質的含量,其中OA的檢出限為10-8mol/L。
章魚胺和酪胺混合溶液274nmHPLC色譜圖 受體分離純化 OA受體的分離純化工作由於缺少高親和力或不可逆OA配體而一度停滯不前,直到NC-5Z被作為一個光親和配體出現。該標記配體被用於飛蠅(photinus pyralis)光器官膜,標記物濃縮後得到一個75KDa的結合蛋白。該蛋白和飛蠅光器官的OA-敏感性腺苷酸環化酶活性很類似,一些拮抗劑的作用強弱順序為:mianserin>cyproheptadine>OA>phentolamine>propranolol。胺基酸序列分析結果顯示,它的N末端胺基酸排列為:NH2-D-[D]-I-K-L-S-Q-Q-[Y]-D-V-L-D-L-F-K-Y-M-[H]-Q…。意外地發現這個AA序列無論和脊椎動物腎上腺素受體還是和一個從果蠅中克隆出的OA受體無任何同源性。繼續研究正著重於該蛋白的整個胺基酸序列的決定,以建立該75 KDa蛋白和一個功能性OA受體之間的聯繫。Arakawa等於1990年成功地從果蠅(Drosophila)中克隆出一個七跨膜結構的OA/酪氨受體。該受體編碼含601個胺基酸,總分子量為64.7 KDa。發現它既可活化腺苷酸環化酶,又能使胞內Ca2+水平提高。它在CHO細胞中表達時可有效地抑制由forskolin誘導的cAMP累積。對CHO細胞進行毒素前處理髮現,它對cAMP的累積作用被阻斷,而[Ca2+]i的瞬間上升現象不受干擾。可以推斷,該受體應通過不同的G蛋白與效應器偶聯。類似的現象在研究蕈毒鹼和α-腎上腺素受體的偶合時也曾觀察到。研究表明,不同的激動劑可能和該受體的不同第二信使系統作用,這就使得區分它究竟是酪氨Tyramine受體還是OA受體抑或是苯酚胺型受體變得複雜化,問題的澄清有待於該克隆受體的內源性配體結構的決定。
章魚胺及添加樣品HPLC圖譜 生理機制 昆蟲體內生理功能 昆蟲體內的OA和TA與脊椎動物體內的腎上腺素和去甲腎上腺素功能頗為相似,在體內也都是以酪氨酸(Tyr)為底物通過一系列酶促反應合成的。酪氨酸可通過酪氨酸羥化酶(TH)羥基化作用生成多巴(DOPA),而酪氨酸與多巴又可分別在酪氨酸脫羧酶(TDC)和多巴脫羧酶(DDC)脫羧基作用下生成相應的TA和多巴胺(dopamine,DA),TA和多巴胺可進一步通過酪胺β-羥化酶(TβH)和
多巴胺 β-羥化酶(DβH)發生β-羥基化作用而生成相應的OA與去甲腎上腺素,從此可看出兩條合成途徑的相似性,去甲腎上腺素則可進一步在苯乙醇胺-N-甲基轉移酶(PNMT)作用下生成
腎上腺素 。另外,如果不存在酪氨酸脫羧酶(TDC),生物體內還有一些補救途徑來完成TA和OA的合成。
章魚胺的生理功能作用示意圖 人們發現昆蟲中央神經系統中的OA含量大大高於NA的含量,從許多昆蟲神經或血液中發現OA的存在,如:美洲大蠊的頭部和血液;Drosophila頭部CNS;蝗蟲Schistocercaamericana腦部CNS和血及胸部神經索;蜜蜂Mamestra configureta頭部CNS;熒火蟲尾部發光器官;捲葉蛾的嗅覺器官等。其它節肢動物體的CNS和血液中也廣泛發現OA存在。如軟體動物蝸牛Sepia officinalis和Loligo valgavis,Aplysia californica,Helixaspersa,Helix pomatia和Oligochaeta腦部CNS中發現OA大量存在;甲殼類動物螃蟹Carcinus maenas血液和龍蝦血液也發現含有大量OA。從前發現OA與昆蟲的搏鬥或飛行的行為活動有關,後來人們相繼發現昆蟲體內OA具有重要的調節生理活動及物質、能量代謝的功能和作用:如調節脂類及碳水化合物的代謝;調節神經肌肉的傳導,骨骼肌的收縮;控制腸道和卵巢中肌肉收縮;抑制非洲蝗蟲輸卵管收縮。OA調節飛行肌肉的代謝;控制螢火蟲尾部發光器官放光;影響蜜蜂的排泄行為;調節昆蟲取食等其它行為。
酪胺章魚胺及衍生物DPPH 自由基清除率 Woodring等發現蟋蟀在不同發育時期其腦部CNS中的OA含量是不同的;Perriere等研究蜚蠊(Blaberuscraniifer)CNS中OA、吲哚胺和兒茶酚胺等生物胺含量時,發現性別、齡期因素對OA分布及含量有一定影響;Harris等研究蜜蜂Apis MelliferaL.不同發育階段OA等生物胺含量的變化規律,結果表明新羽化的蜜蜂CNS中OA含量顯著低於普通成蟲。這說明OA具有調節昆蟲生殖及發育功能的作用。David等研究發現,處於超興奮狀態的螞蟻腦部CNS中OA含量高於極度抑鬱的螞蟻腦部OA含量,這說明昆蟲體內的OA具有一定的調節“心情”狀態的作用。另外,OA極有可能在同種昆蟲間的信息傳遞過程中起著不可替代的作用。新羽化Manduca sexta和Mamestraconfigureta的工蜂眼睛中OA含量的升高意味著同種工蜂成蟲之間正在發布信息指令。Klassen等還發現生活在高種群密度中的工蜂腦部OA含量較普通蜜蜂高與工蜂覓食行為有關。Essam發現,可作為殺蟲劑的3種香精油(eugenol,terpineol and cinnamic alcohol)及其混合物對美洲大蠊、螞蟻和德國小蠊有明顯作用,這些香精油是神經性殺蟲劑,它們的作用靶標可能是OA受體。
昆蟲體內作用機制 OA主要作為神經遞質,其作用包括環腺苷酸和肌醇三磷酸(IP3)細胞內第二信使的產生。外界刺激(如化合物)與細胞表面受體部分接受後,主要通過膜上G蛋白,偶聯激活同樣處於膜上的酶或離子通道,產生第二信使(胞內信使),以完成跨膜信號轉換,最終導致細胞反應。最早發現的第二信使是cAMP,它的產生是在腺苷酸環化酶(Adenylate Cyclase,AC)催化下,由ATP脫去一個焦磷酸形成的。細胞內微量的cAMP(僅為ATP的千分之一)在短時間內迅速增加數倍以至數十倍,從而形成胞間信號。而cAMP信號在環核苷酸磷酸二酯酶(cAMP-PDE)催化下水解,產生5′-AMP,將信號滅活。胞內信使cAMP產生以後,主要通過蛋白質磷酸化作用繼續傳遞信息,由依賴cAMP的蛋白激酶(PKA)將代謝途徑中的一些靶蛋白中的絲氨酸或蘇氨酸殘基磷酸化,將其激活或鈍化。這些被共價鍵修飾的靶蛋白往往是一些關鍵性調節酶或重要功能蛋白,因而可以介導胞外信息,調節細胞反應。細胞膜上存在受體(R)、偶聯的G蛋白(G)、AC三種蛋白質,胞外的刺激信號或抑制信號分別為刺激性或抑制性受體接受,通過G蛋白傳遞給共同的腺苷酸環化酶,使其激化或鈍化;一旦AC被激活,細胞溶質部分產生cAMP,通過PKA使蛋白質磷酸化進而調節細胞反應,cAMP的滅活與信號終止是靠PDE的分解作用。Downer小組發現OA受體的cAMP系統可能與另一個第二信使DG有關。由DG活化的CF1細胞中的蛋白激酶可能通過GS亞基對OA受體的cAMP產生調節作用。Wierenga和Hollingworth發現OA在昆蟲組織內的吸收有兩種類型的抑制劑,它們對鈉離子通道或N-乙醯化轉化酶(NAT)起阻斷作用。這個結果表明,OA的吸收與代謝之間應有某種關聯。
生物體內酪氨酸生成不同生物胺的合成途徑 OA受體的激動劑與拮抗劑及其藥理學已經發現了幾類OA受體激動劑的化學結構。殺蟲脒的代謝產物去甲基殺蟲脒是比其本身強的激動劑。類似的發現還有硫脲類殺蟎隆,其代謝的碳化二亞胺形式可更強地激活腺苷酸環化酶。一些口惡唑啉(如AC-6)、
咪唑啉 (如NC-5)、
噻唑啉 也是OA受體的部分激動劑。
OA受體的拮抗劑具有類似Mianserin的結構。激動劑和拮抗劑在藥理學上的一個重要用途就是用於鑑定和分辨受體類型。已判別和鑑定了OA的四個受體類型,即OA1、OA2A、OA2B和OA3,它們相互影響而發揮其作用。在OA受體分類研究的早期,甲脒類(如CDM)和苯基咪唑烷類被廣泛套用,但沒有發現其對OA受體表現出選擇性。直到1984年,Evans等發現一些咪唑啉(如NC-5和NC-7)激動劑對一些OA受體呈現不同的藥理效率。根據藥理學和生理學研究,Evans把蝗蟲伸肌-脛節神經肌肉中的OA受體分為三類,即OA1、OA2(OA2A,OA2B)。根據拮抗劑的強弱程度可以把OA1(Chlorpromazine>Yohimbine metoclo-pramide)和OA2(metoclopramideChlorpromazine>Yohimbine)區分開來。一些激動劑的不同反應也提供了佐證,作用於OA1受體時,clonidine naphazoline,作用於OA2受體時強弱順序則正好反過來。據生理學實驗推測,OA1受體調節肌肉中肌源性節奏收縮,作用於OA1受體並不引起cAMP水平改變,而所有增加cAMP含量的藥劑作用於該受體時反而加速節奏,與OA的收縮作用相反。該類受體可能通過影響肌肉纖維細胞中膜內Ca2+水平而影響IP3作用。OA2受體則通過慢性運動神經的神經肌肉轉化。OA2受體可細分為OA2A和OA2B兩個亞型。OA2A受體主要存在於慢性運動神經的突觸前膜的末端,OA2B存在於突觸後膜肌肉纖維中。它們的藥理學分類基於一些拮抗劑的IC50值。刺激突觸前膜上的OA2A受體可提高末端的Ca2+透過性,以增加轉移時的神經喚醒性釋放。OA2B受體則通過調節cAMP水平,以提高自由鈣離子進入肌質網(SR)的連續性,從而使肌肉緊張弛緩。OA2A受體作用於磷酸化途徑及促使Ca2+進入線粒體的機制還有待進一步研究。繼續研究發現:昆蟲的OA受體與哺乳動物的腎上腺素受體亞型有一定的不同,甚至相反的表現。鄰位取代OA比相應的對位取代OA衍生物對腎上腺素受體作用更強,而對OA1受體作用時則正好反過來。光活性(-)-p-OA和(-)-p-Synephrine比去甲腎上腺素對OA1受體作用強,而對腎上腺素受體作用時,強弱順序就完全不同。自從Evans開創性分類工作以來,已有大量文獻報導。在各種昆蟲組織中存在不同受體類型,它們中大多數表現出與OA2相似的藥理學特徵。例如:Orchard和Lange報導了蝗蟲輸卵管(oviduct)中OA受體調節OA活性;Pannabecker等描述了蝗蟲心側體(corpus cardicum)的腺葉中cAMP反應;著名的OA研究學者Nathanson報導了飛行光器官中的cAMP反應;Lafon-Cazal等對蝗蟲飛行肌肉的cAMP回響研究,也說明這些OA受體與最早研究的蝗蟲伸肌-脛節肌肉OA2受體同屬一類。一些昆蟲的中央神經系統,包括蝗蟲的cAMP累積,果蠅頭膜、Cer-atitis腦膜以及果蠅頭膜中[3H]OA結合、蝗蟲神經組織膜等的實驗則基本吸收了一些激動劑OA2受體的研究方法。在蜚蠊的超神經肌肉中、Locust Migratoria腦中也檢測到了OA2受體或結合部位。Swales和Evans還提出了蝗蟲伸肌-脛節中OA-敏感性腺苷酸環化酶活性的證據。Banner等證明骨骼肌肉組織中的OA2受體確實與一個腺苷酸環化酶相偶聯。
章魚胺酪胺受體偶聯胞內信號轉導途徑 Roeder等用配體結合測定法測得蝗蟲神經組織中有一個[3H]-OA結合部位。這個靶和OA2有一些相似之處,但其對mianserin等拮抗劑的表現則有其獨特之處。最初有些學者主張將其命名為OA2C,但通過定量相關分析,這個靶應歸屬於第三類型,即神經性OA3受體。OA3受體和clonidine、甲脒類、phentolamine、mianserin等有很強的親和作用,但和metoclo-pramide作用較弱,而metoclopramide是OA2受體的高親和力配體。一些對哺乳動物組胺H1受體作用強的配體如mianserin、mepyramine、cyproheptadine等和OA2受體結合也強,反之亦然。因此可以推測這兩類受體結構應有一定的類似性。
環境的改變對含量影響 OA的存在及含量的變化對各種節肢動物的生長和行為具有顯著的生物效應,而不良的生存環境對節肢動物體內的章魚胺的分布及含量變化將會產生不同程度的影響。一些研究學者曾經對此問題進行了研究。Davenport等研究發現,經過機械振盪及體溫升高后美洲大蠊及蝗蟲血液中OA含量顯著升高。Woodring等研究發現改變光照時間及機械振搖後蟋蟀Acheta domesticus的腦部CNS中OA含量增加。Davenport等發現,飢餓導致蝗蟲血液中OA含量發生了變化[11]。Hirashima等通過用升高環境溫度及閃光燈照射的方法考察美洲大蠊胸部神經索中OA等生物胺水平變化,結果為OA在2種環境刺激下都顯著升高。對OA等生物胺含量變化與甲殼類動物的某些行為活動特別是搏鬥行為的關係的研究引人注目。OA、DA(多巴胺,Dopamine)、去甲腎上腺素、5-羥基色胺(5-HT)和酪胺等生物胺被認為是多細胞動物取食、搏鬥等一系列行為活動的神經控制劑。Horner等的研究工作得到一個有意思的結果:把OA和5-HT注射到龍蝦H.americanus的血液中,導致行為異常,而且5-HT的注入導致龍蝦更具侵略性,而且在搏鬥過程中不願“認輸投降”。Sneddon等研究了雄性海岸螃蟹Carcinusmaenas的搏鬥行為與血液中OA等生物胺含量變化的關係。該試驗設計為供試動物Carcinus maenas搏鬥前後及長時間爬行(treadmill)後OA、DA、酪胺、5-HT及去甲腎上腺素的含量測定。通過計算比較可以發現,搏鬥可以影響OA、DA、5-HT的含量。運動(exercise)僅僅影響OA水平變化。搏鬥後的獲勝方體內OA、DA、5-HT水平高於失敗方,失敗方體內OA的含量隨著搏鬥程度的加劇而下降。同時發現:搏鬥過程中如果失敗一方體內OA含量高,那么它就會表現出馴服的姿態;若OA含量低,這一方便搏鬥更加激烈。獲勝一方體內OA含量變化沒有導致上述現象發生。對於上述研究結果有不同的解釋。一般認為OA等生物胺的作用表現為行為功能的短期抑揚調節物(up-regulator and down-regulator),這種功能影響行為(如搏鬥)變化,從而使神經系統有機會通過受體基因表達或者第二信使傳遞來調整。
化學藥劑進入昆蟲體後在神經細胞之間的傳遞過程包括:刺激神經遞質的合成和釋放,神經遞質與蛋白質受體的結合以及隨之產生的離子滲透性激活變化從而對神經衝動的傳遞發生影響,並對神經傳遞介質的降解、再攝取過程密切相關。Davenport等運用同位素酶法測得蝗蟲血液中OA含量為5.6 pg/μL血液,並且發現經過殺蟲脒、克白威、氯菊酯、滴滴涕和林丹等殺蟲劑處理後試蟲血液中OA含量不同程度地升高,其中只有殺蟲脒、克白威和氯菊酯能夠導致血液中OA含量顯著性增加。該研究結果表明,化學藥劑雖然能夠導致昆蟲血液中OA含量的升高,但是不能解釋OA在循環系統中的作用。Hirashima等採用高壓液相色譜(HPLC)連線電化學檢測器(HPLC-ECD)的方法測得美洲大蠊Periplaneta americana每隻試蟲CNS中含有48.8ng/g組織的OA,並得到40 pg/g組織的最小檢出量,該學者還研究了殺螟松、殺蟲脒、仲丁威、丙烯菊酯和林丹5種殺蟲劑作用於美洲大蠊後其頭部OA等生物胺含量變化,研究發現,以上5種藥劑都能夠引起CNS中OA含量顯著性升高;而Davenport等發現有機氯殺蟲劑滴滴涕和林丹並不引起蝗蟲Schistocercaamericana血液中OA含量顯著性增加。khan等的研究認為,OA通常通過和OA受體的相互作用激活腺苷酸環化酶來提高細胞內環腺苷酸(cAMP)水平,他們用幾種苯甲醛取代的腙和縮氨基脲作用於蠶,然後用同位素方法測cAMP含量的變化,從而確定這幾種化合物對生物胺受體的影響,結果發現2,6二氯苯腙和OA都可使蠶頭部勻漿中cAMP含量增加,cAMP作為第二信使來調節昆蟲的生理反應。
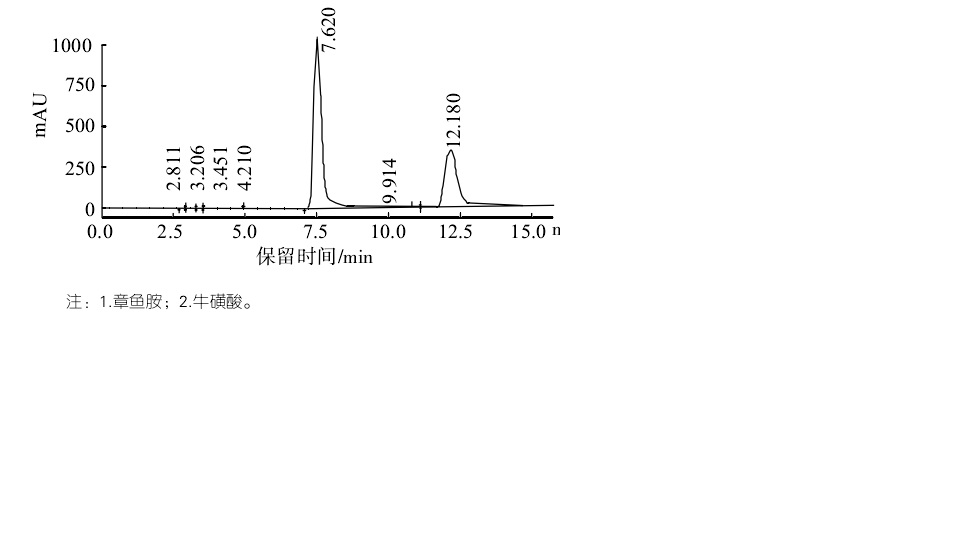 牛磺酸及章魚胺衍生物色譜圖
牛磺酸及章魚胺衍生物色譜圖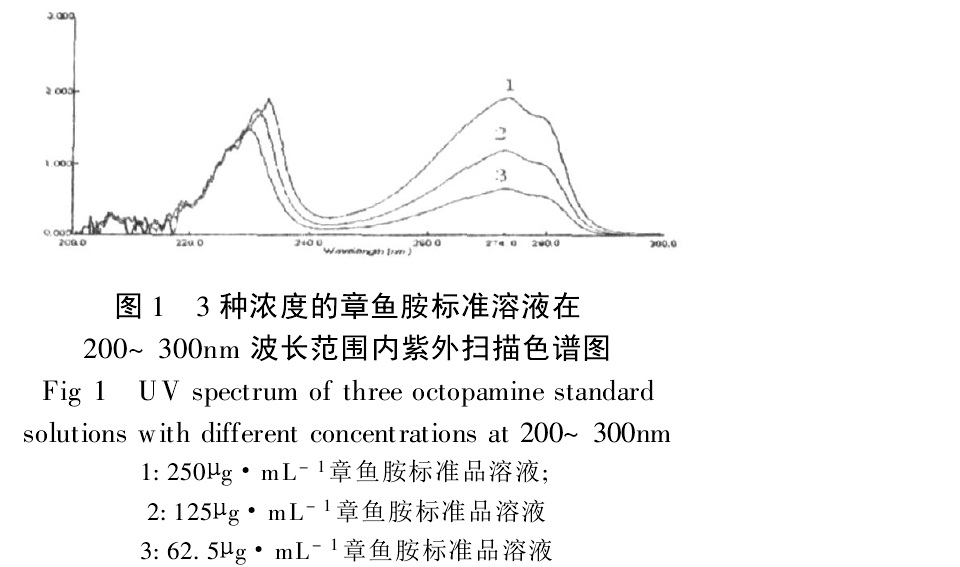 3種濃度的章魚胺標準溶液紫外光譜
3種濃度的章魚胺標準溶液紫外光譜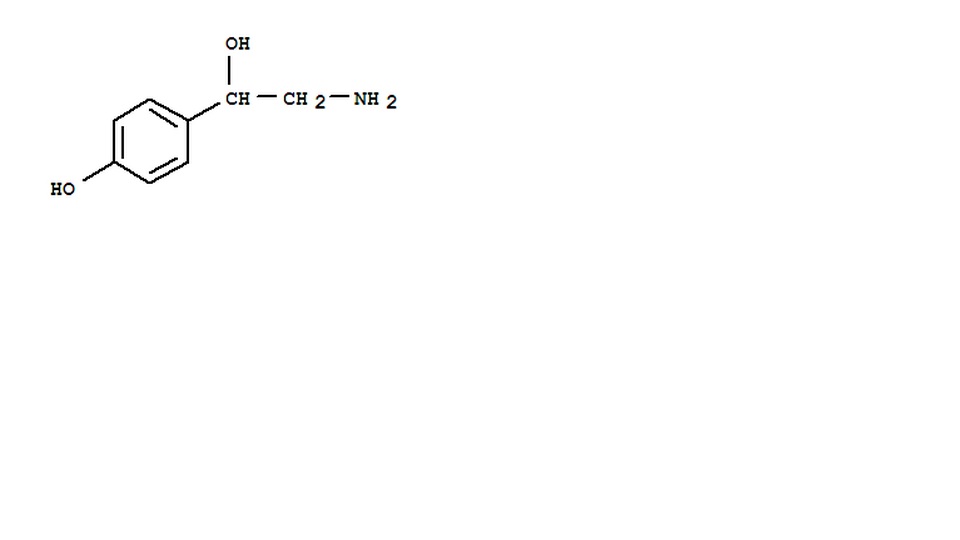 章魚胺結構式
章魚胺結構式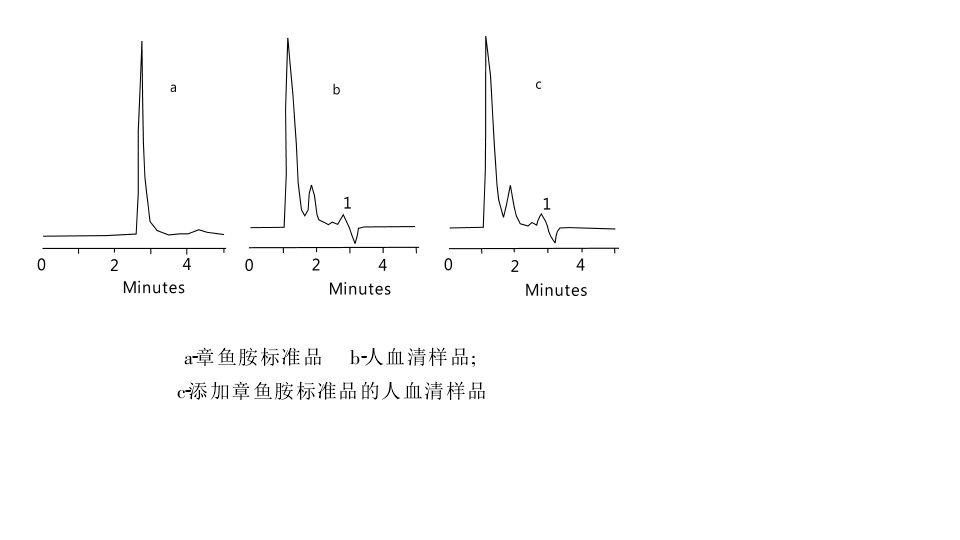 章魚胺在220nm的HPLC色譜圖
章魚胺在220nm的HPLC色譜圖 章魚胺衍生物
章魚胺衍生物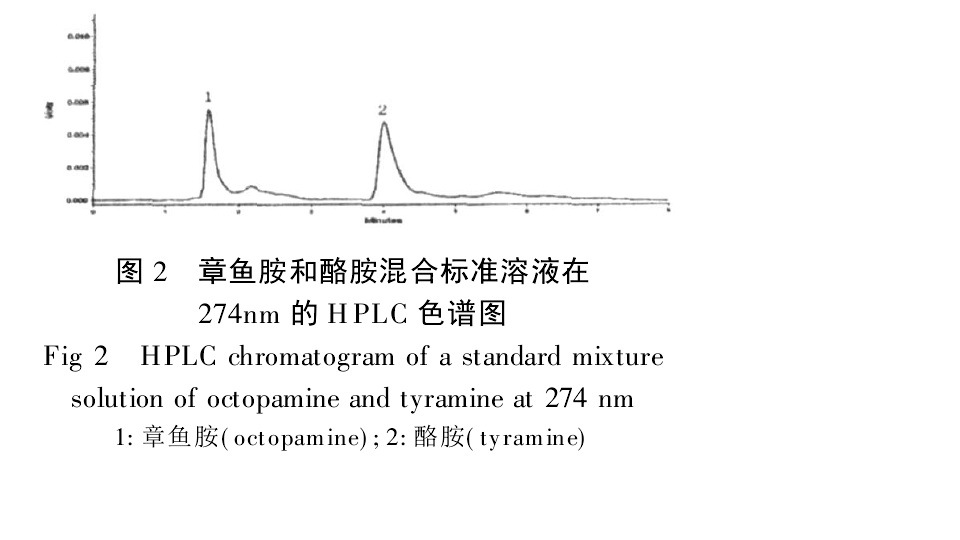 章魚胺和酪胺混合溶液274nmHPLC色譜圖
章魚胺和酪胺混合溶液274nmHPLC色譜圖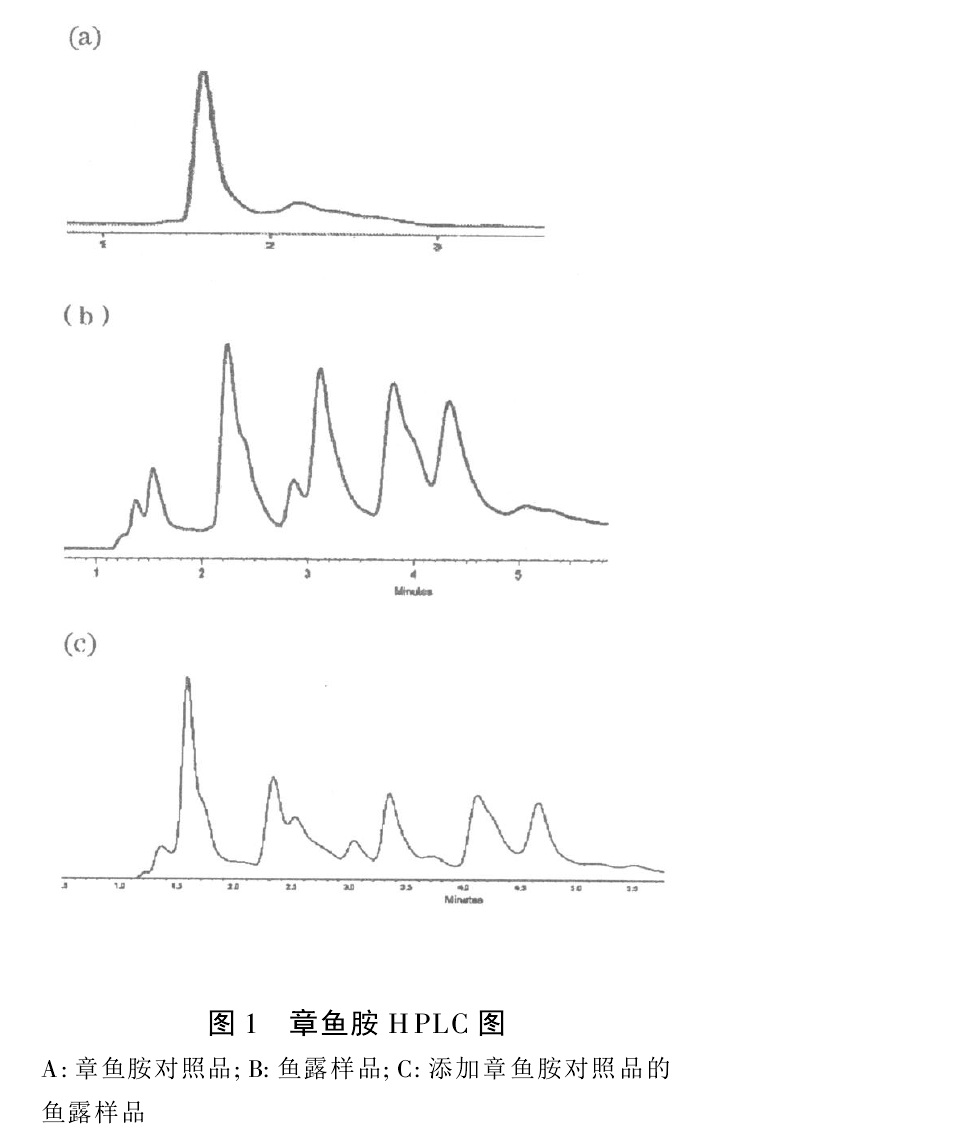 章魚胺及添加樣品HPLC圖譜
章魚胺及添加樣品HPLC圖譜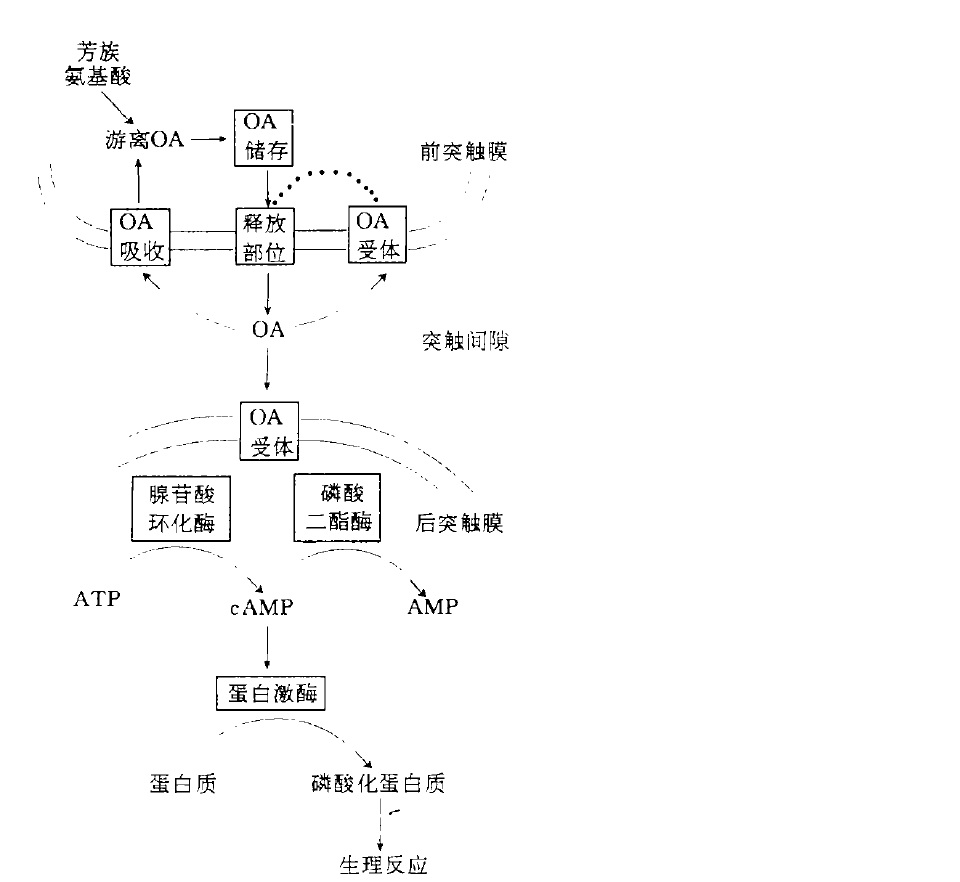 章魚胺的生理功能作用示意圖
章魚胺的生理功能作用示意圖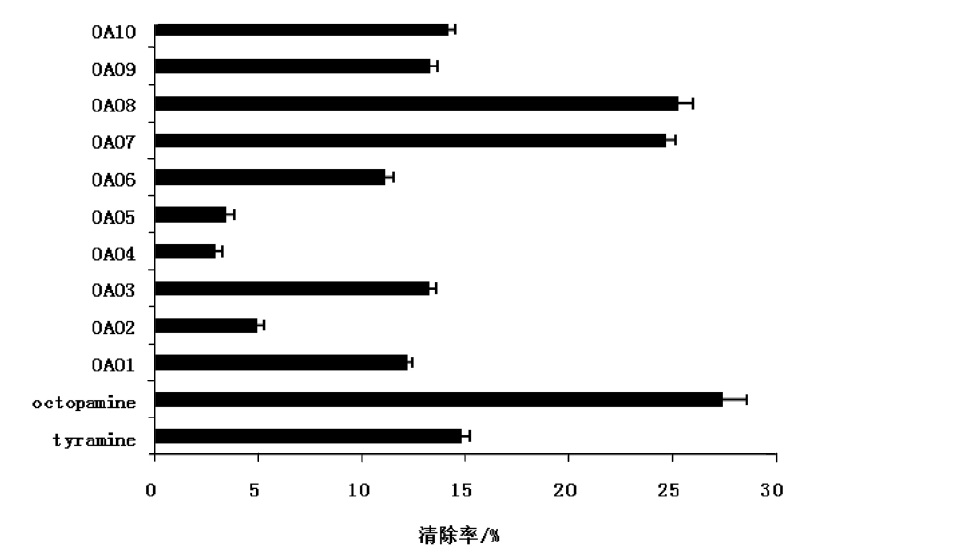 酪胺章魚胺及衍生物DPPH 自由基清除率
酪胺章魚胺及衍生物DPPH 自由基清除率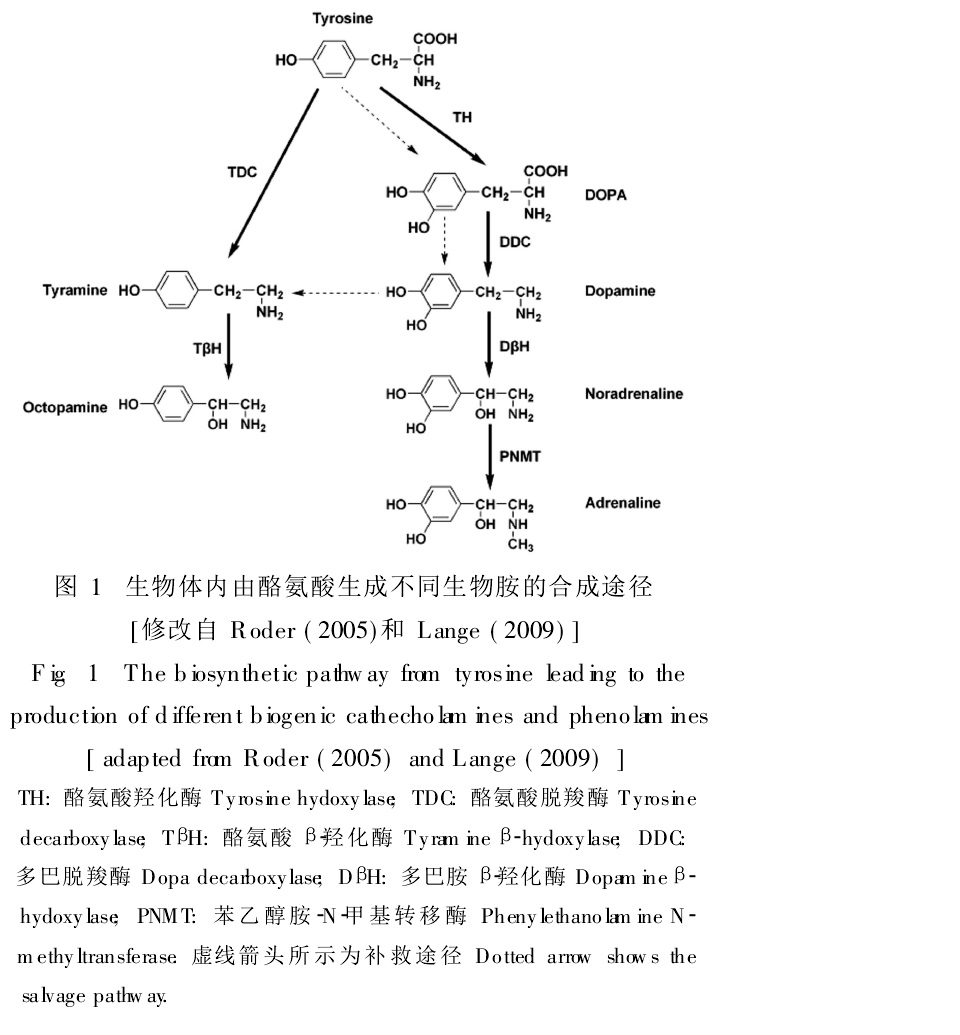 生物體內酪氨酸生成不同生物胺的合成途徑
生物體內酪氨酸生成不同生物胺的合成途徑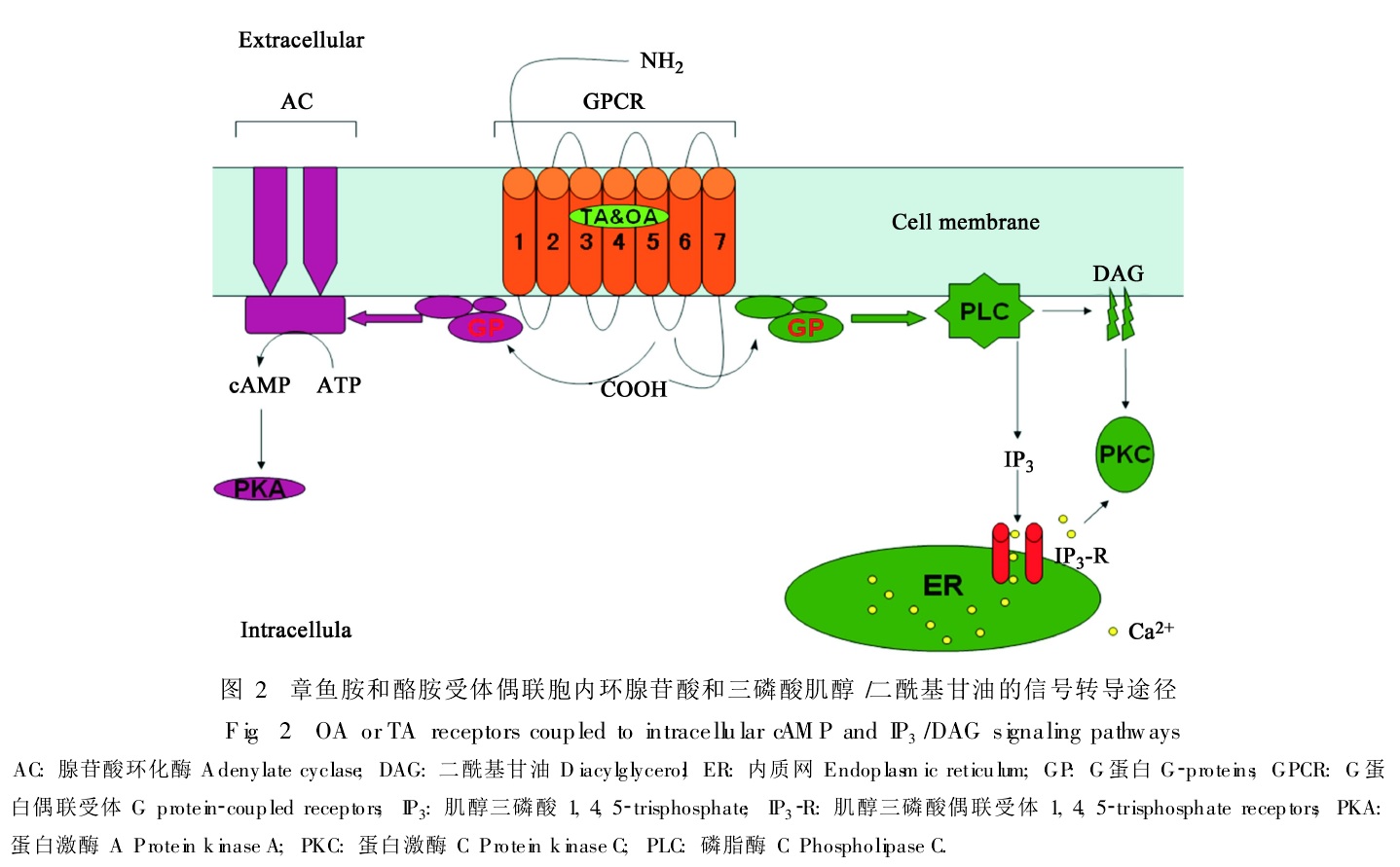 章魚胺酪胺受體偶聯胞內信號轉導途徑
章魚胺酪胺受體偶聯胞內信號轉導途徑