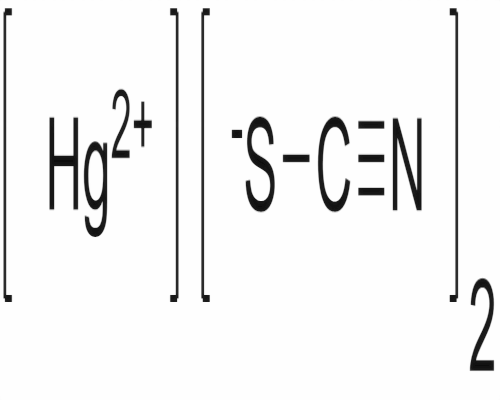硫氰化汞的外觀為白色粉末或針狀結晶。無氣味。約在165℃分解為金屬汞和氮氣等。溶於稀鹽酸、氰化鹼和氯化鹼溶液,微溶於冷水,較多溶於熱水並同時分解。有毒。硫氰化汞可溶於苯、己烷及甲基異丁基酮等有機溶劑中。硫氰化汞可以由含有汞離子及硫氰酸根離子的溶液反應而成,由於硫氰化汞對水的溶解度很低,會形成沉澱。硫氰化汞可用在化學合成中,在合成含硫氰酸根及汞離子的化合物時也會用到硫氰化汞。硫氰化汞也可以用在有機合成中,和有機化合物進行雙分子親核取代反應,用硫氰酸根取代化合物中的鹵素。因為硫氰酸根的二端都會與有機化合物反應,所產生的產物會是二種化合物的混合物,其中一種是硫氰酸根中硫和有機化合物的碳鏈連結,另一種則是用氮元素和有機化合物的碳鏈連結。
基本介紹
- 中文名:硫氰化汞
- 外文名:mercuric thiocyanate
- 別名:硫氰酸汞
- 化學式:Hg(SCN)2
- 相對分子質量:316.79
- 化學品類別:無機物--硫氰酸鹽
- 管制類型:劇毒品
- 儲存:密封保存
發現簡史,理化性質,物理性質,化學性質,套用領域,套用,檢測,注意事項,危險性概述,急救措施,消防措施,泄漏應急處理,操作處置與儲存,
發現簡史
最早合成硫氰酸汞(硫氰化汞)的化學家可能是永斯·貝采利烏斯,在1821年合成。
1820年入馬爾堡醫科大學學醫,但仍常在宿舍中進行化學實驗。他的第一篇科學論文是“關於硫氰酸汞(硫氰化汞)的性質”,發表在“吉爾伯特年鑑”上並受到著名化學家貝采里烏斯(JonsJ·Berzelius)的重視。他最早研究的是不溶於水的硫氰酸銀和硫氰酸汞(硫氰化汞)的性質問題。
有一次,當他把硫氰酸按溶液與硝酸汞溶液混和時,得到了硫氰酸汞(硫氰化汞)的白色沉澱。經過過濾,他把沉澱物放在一邊,讓它自然地乾燥著,自己就躺下去睡覺。但他腦子裡還總想著實驗的事,無論如何也不能人睡。於是乾脆爬起來,重新點燃蠟燭,接著做實驗。他將一部分硫氰酸汞(硫氰化汞)放在瓦片上,讓它靠近壁爐里熊熊燃燒的炭火。不一會兒,瓦片被燒熱了,上面的白色粉末開始僻啪作響,並逐漸在瓦片上分散開來。他注視著所發生的一切現象。響聲停止後,他取了一點白色粉末,蘸上點水,用手把它揉搓成一根白色的長條。放在瓦片上乾燥片刻,然後給瓦片的一端猛烈加熱。於是,重新又聽到僻僻啪啪的聲音,白色的長條受熱後開始劇烈地膨脹著,形成了一個大氣泡。那氣泡像球一樣飛快地向另一端滾去。待反應停止後,剩下了一塊不能流動的黃色物質。經過幾個月的深入研究,他在自己的第一篇科學論文中,詳細地描述了這個現象。由布赫醫生推薦,這篇論文發表在《吉爾伯特年鑑》上。該文發表後,立即引起了瑞典化學家貝采里烏斯的重視。他在撰寫《年度述評》中,以十分讚許的口吻對維勒的論文給予了肯定的評價。
理化性質
物理性質
外觀與性狀:白色無臭味的粉末或針狀結晶。
EINECS號 | 209-773-0 |
熔點(℃) | 165(分解) |
密度 | 3.71 g/mL at 25 °C(lit.) |
溶解度 | 0.069g/100mL水(25℃) |
水中溶解度(g/100ml) | 6.3×10-2/20℃ |
閃點 | 120 °C |
592-85-8 | |
Mol檔案 | 592-85-8.mol |
化學性質
穩定性:
要避免的物料:氧化物,水分,酸,熱 受熱分解產生的蛇狀物質
受熱分解產生的蛇狀物質
 受熱分解產生的蛇狀物質
受熱分解產生的蛇狀物質危險的反應:和酸接觸釋放劇毒氣體
接觸酸或酸氣能產生有毒氣體。加熱分解出高毒煙氣,並生成彎曲蛇狀物質。
2Hg(SCN)2=2HgS+CS2+C3N4。C3N4不穩定,易分解:2C3N4==3(CN)2↑+N2↑
毒理學數據:
口腔 | LD50 46mg/kg(rat) |
皮膚 | LD50 685mg/kg(rat) |
生態學資料:
1.毒性:無可用數據;
2.持久性和降解:無可用數據;
3.生物蓄積性:無可用數據;
4.土壤中的遷移:無可用數據;
5.其它不利的影響:對水生生物毒性極大並具有長期持續影響。
計算化學數據:
氫鍵供體數量 | 0 |
氫鍵受體數量 | 8 |
可旋轉化學鍵數量 | 0 |
拓撲分子極性表面積(TPSA) | 95.2 |
重原子數量 | 0 |
複雜度 | 31.1 |
共價鍵單元數量 | 7 |
確定原子立構中心數量 | 0 |
不確定原子立構中心數量 | 0 |
確定化學鍵立構中心數量 | 0 |
化學實驗:
化學原理:硫氰化汞白色粉末,受熱易分解,體積膨脹很大,像彎曲生長的蛇。 化學反應如下:
4Hg(SCN)2 =4HgS + 2CS2 + 3(CN)2↑ + N2↑
硫氰化汞不溶於水,以Fe3+作指示劑,當溶液變成紅色時,說明Hg2+已完全沉澱,如果硫氰化鉀過量,硫氰化汞則會生成絡合物而溶解。
Hg2++ 2SCNˉ=Hg(SCN)2↓
實驗用品:
藥品:0.1摩/升硝酸汞溶液、0.1摩/升氯化鐵溶液、1摩/升硫氰化鉀溶液、糊精。
儀器:400毫升燒杯、玻棒、吸濾瓶、酒精燈、滴管、錐形紙模子。
步驟及現象:
實驗步驟及現象:
1、燒杯中倒入0.1摩/升硝酸汞溶液300毫升,滴入10滴氯化鐵溶液,然後逐滴加入1摩/升硫氰化鉀溶液60毫升,直到剛出現紅色,經攬拌而不褪色為止。
2、用吸濾瓶抽濾得硫氰化汞沉澱,取出晾乾。
3、將乾燥的硫氰化汞加入適量糊精和水調成糊狀,灌入錐形模子,晾乾。用火點燃錐狀物的尖端,就有黃綠色煙產生,曲曲折折而成蛇狀。
以上實驗就是著名的法老之蛇實驗。
硫氰化汞分光光度法原理:
用稀氫氧化鈉溶液吸收氯化氫(HCl)。吸收溶液中的氯離子和硫氰化汞反應,生成難電離的二氯化汞分子,置換出的硫氰酸根與三價的鐵離子反應生成橙紅色硫氰酸鐵絡離子,根據顏色深淺,用分光光度法測定。
套用領域
套用
用於煙火和照相顯影劑。
檢測
硫氰酸汞分光光度法::
1.方法原理
空氣中溴化氫和氫溴酸用多孔玻板吸收管採集,在酸性溶液中,溴化氫與硫氰酸汞反應生成紅色絡合物;於460nm波長下測量吸光度,進行測定。
2.材料和方法
2.1. 儀器
(1)多孔玻板吸收管。
(2)空氣採樣器,流量0~1L/min。
(3)具塞比色管,10ml。
(4)UV755B分光光度計。
2.2. 試劑
(1)吸收液:氫氧化鈉溶液(4g/L)。
(2)硫氰酸汞溶液:0.4g 硫氰酸汞溶於100ml 無水乙醇中。
(3) 硫酸鐵銨溶液:溶解12g硫酸鐵銨於水中,加入40ml硝酸(ρ20=1.42g/ml),用水稀釋至100ml;如有沉澱應過濾後使用。
(4)標準溶液:準確稱取0.2044g 溴化鉀(於105℃乾燥2h),溶於吸收液中,用吸收液稀釋成10.0*g/ml溴化氫標準溶液。
2.3. 樣品的採集、運輸和保存。現場採樣按照GBZ159執行。在採樣點。將一隻裝有10.0ml吸收液的多孔玻板吸收管,以500ml/min流量採集15min空氣樣品。採樣後,立即封閉吸收管進出氣口,置清潔容器內運輸和保存。樣品應在48h內測定。
2.4. 分析步驟
2.4.1.對照試驗:將裝有10.0ml 吸收液的多孔玻板吸收管帶至採樣點,除不連線空氣採樣器採集空氣樣品外,其餘操作同樣品,作為樣品的空白對照。
2.4.2.樣品處理:用採過樣的吸收液洗滌吸收管進氣管內壁3次。取出5.0ml樣品溶液於具塞比色管中,供測定。若樣品液中待測物的濃度超過測定範圍,可用吸收液稀釋後測定,計算時乘以稀釋倍數。
2.4.3.標準曲線的繪製:取6隻具塞比色管,分別加入0.0、0.50、1.0、2.0、3.0、4.0ml 溴化氫標準溶液,各加吸收液至5.0ml,配成0.0、5.0、10.0、20.0、30.0、40.0*g 溴化氫標準系列。各標準管加1ml 硫酸鐵銨溶液,搖勻;加1.5ml硫氰酸汞溶液,搖勻,用水稀釋至10ml,搖勻。放置20min,於460nm波長下測量吸光度;每個濃度重複測定3次,以吸光度均值對相應的溴化氫含量(*g)繪製標準曲線。
2.4.4.樣品測定:用測定標準系列的操作條件測定樣品和空白對照溶液。樣品吸光度值減去樣品空白對照吸光度值後,由標準曲線得溴化氫含量(*g)。
3.結果
3.1. 標準曲線範圍、檢出限。該法的檢出限為0.4*g/ml;最低檢出濃度為0.5m g/m3(以採集7.5L空氣樣品計)。測定範圍為0.4~8*g/ml;相對標準偏差為0.6%~1.0%。溴化氫的職業衛生接觸限值為最高容許濃度10mg/m3。測定濃度範圍應在0~10 mg/m3之間,按採氣量7.5 L、取樣量5.0ml,標準曲線的範圍應為0—40*g。將標準曲線範圍定為5-150g,標準系列各濃度點為0.0、5.0、10.0、20.0、30.0、40.0*g,在此測定範圍內有良好的線性關係。
方法的檢出限:對試劑空白溶液進行10次測定,3倍標準差對應的待測物含量計算,檢出限為0.4*g/ml,以採集7.5 L空氣樣品計,最低檢出濃度為0.5mg/m3。
3.2. 採樣效率。該法的採樣效率為94.4%~100%。在某溴化物生產現場和使用現場,各選定高、低2個濃度採樣點,採用多孔玻板吸收管串聯的方式進行採樣,並目評價採樣管的採樣效率。生產現場多孔玻板吸收管測定結果為4.0mg/m3、9.0mg/m3,採樣效率為100%。使用現場測定結果為
1.7mg/m3、2.8mg/m3。測定結果基本反映了現場實際睛況。
3.3. 樣品穩定性實驗。樣品室溫下可放置10d ,顯色後可穩定2h。取24支試管,各加入10 ml吸收液、50.0g溴化氫標準溶液,室溫下放置。分別於當日及第3、5、7和10天測定其含量。結果顯示,樣品室溫下放置10d,下降率僅為1.6%,說明樣品在室溫下至少可放置10d。
3.4. 干擾實驗。氯化物、碘化物、硫化氫和氰化氫對測定有干擾。由於溴化氫的使用藝是以溴化氫作為催化劑使用,無其他干擾物。選擇的使用現場為化纖生產企業,現場共存物有聯苯,苯醚,對苯二甲酸,無其他溴化物。經試驗驗證這些物質均不干擾溴化氫的測定。
3.5. 方法的準確度:將現場分析後剩餘的樣品合併置100ml容量瓶中,加吸收液至刻度後,分成組,每組6個樣品,每個樣品5ml,一組測定其本底濃度,另外兩組分別加入25、100µg溴化氫標準套用液,測定其加標回收率,測定結果為96.8%~101.6%。
注意事項
危險性概述
健康危害:對呼吸道、眼和皮膚有刺激性,可致灼傷,可經呼吸道、皮膚吸收引起中毒。長期接觸引起中樞神經系統損害。對腎和皮膚有損害,出現口腔炎及牙齒鬆動等。
環境危害:對環境可能有危害,對水體可造成污染。
燃爆危險:該品不燃,高毒。
急救措施
皮膚接觸:立即脫去污染的衣著,用大量流動清水沖洗至少15分鐘。就醫。
眼睛接觸:立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入:用水漱口,給飲牛奶或蛋清。就醫。
消防措施
滅火方法:消防人員必須穿全身防火防毒服,在上風向滅火。滅火時儘可能將容器從火場移至空曠處。然後根據著火原因選擇適當滅火劑滅火。
泄漏應急處理
應急處理:隔離泄漏污染區,限制出入。建議應急處理人員戴防塵口罩,穿防毒服。不要直接接觸泄漏物。
小量泄漏:避免揚塵,小心掃起,收集於乾燥、潔淨、有蓋的容器中。
大量泄漏:收集回收或運至廢物處理場所處置。
操作處置與儲存
操作注意事項:密閉操作,提供充分的局部排風。防止粉塵釋放到車間空氣中。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴防塵面具(全面罩),穿膠布防毒衣,戴橡膠手套。避免產生粉塵。避免與酸類接觸。配備泄漏應急處理設備。
儲存注意事項:儲存於陰涼、通風的庫房。遠離火種、熱源。防止陽光直射。包裝必須密封,切勿受潮。應與酸類、食用化學品等分開存放,切忌混儲。儲區應備有合適的材料收容泄漏物。