疊氮反應是在有機分子中引入疊氮基是用含N-3的親核試劑中N-3取代鹵素、磺酸酯基、硝胺酯基、硝酸酯基等可離去基團,反應機理為親核取代反應(SN)。
基本介紹
- 中文名:diedanfanying
- 外文名:Azide reaction
疊氮反應是在有機分子中引入疊氮基是用含N-3的親核試劑中N-3取代鹵素、磺酸酯基、硝胺酯基、硝酸酯基等可離去基團,反應機理為親核取代反應(SN)。
疊氮反應是在有機分子中引入疊氮基是用含N-3的親核試劑中N-3取代鹵素、磺酸酯基、硝胺酯基、硝酸酯基等可離去基團,反應機理為親核取代反應(SN)。...
定義 疊氮化aaidatinn生成疊氮化合物的反應。例如酞胺1 在鹼存在下與},4}6_三異丙基苯磺酸疊氮2反應轉變成a一疊 氮酸胺3} ...
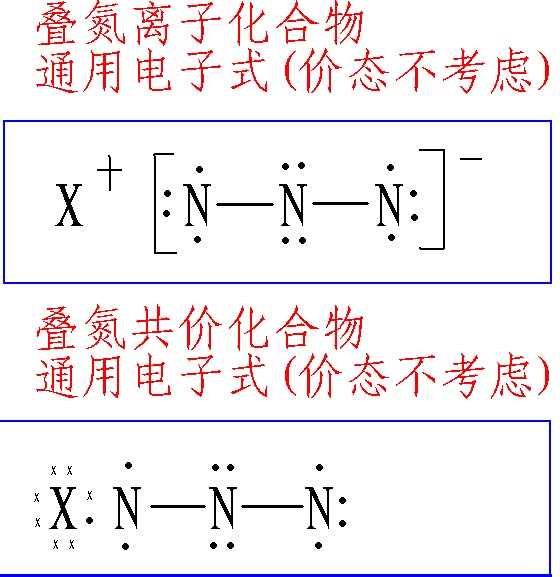
疊氮化合物(英文azides;hydrazoates;trinitride)一類通式為RN3的化合物,R為脂烴基、芳烴基、醯基、磺醯基等或氫,而疊氮基與氫直接相連即為疊氮酸(azoimide)。...
疊氮化鈉亦稱“三氮化鈉”,化學式NaN₃,分子量65.01,白色六方系晶體,無味,無臭,純品無吸濕性。劇毒。相對密度1.846。不溶於乙醚,微溶於乙醇(25℃ 時0....
柯提斯重排反應(英文Curtius rearrangement)是一類親核重排反應,反應中,羧酸與疊氮化物作用生成醯基疊氮化物再重排為異氰酸酯,異氰酸酯水解得到少一碳的伯胺,該反應...
疊氮化氟是化學式為FN3的化學物質。...... 疊氮化氟是一種無機化合物,化學式為FN3,它是一種黃綠色的氣體。疊氮化氟在–82℃液化,在–152°C變為固體。...
疊氮化溴是一種無機化合物,有爆炸性,化學式為BrN3。...... 疊氮化溴是一種無機化合物,有爆炸性,化學式為BrN3。目錄 1 製備 疊氮化溴製備 編輯 ...
施密特重排反應(英文Schmidt rearangement)指的是疊氮酸和羧酸在路易斯酸或硫酸的催化下重排生成異氰酸酯並水解生成少一碳伯胺的反應。在實際操作中,疊氮酸有毒且極...
施密特反應(英文Schmidt反應)是一個有機重排反應,原料在疊氮酸作用下,放出氮氣,發生烷基遷移生成新的C-N鍵。[1]以羧酸作原料時,經由異氰酸酯中間體,產物為少...
高分子疊氮化合物高分子疊氮化合物指分子中含有疊氮基團分子化合物,是高活性高分子試劑,對光和熱敏感。高分子疊氮化合物的合成通常以聚苯乙烯為原料,經氯磺化後,與...
疊氮化硫醯是一種無機化合物,化學式為SO2(N3)2。...... 疊氮化硫醯是一種無機化合物,化學式為SO2(N3)2。中文名 疊氮化硫醯 化學式 SO2(N3)2 性質 無...
疊氮化亞銅是一種化學品,分子式是CuN3,無機化合物,是疊氮酸的亞銅鹽。...... 疊氮化亞銅是一種化學品,分子式是CuN3,無機化合物,是疊氮酸的亞銅鹽。...
RbCO3 + NaN3 → RbN3 + NaCO3疊氮化銣會在氮的影響下的放電,形成氮化銣。...... 當溫度加熱到310°C時疊氮化銣會分解,除了釋放出60%的元素銣外,還會釋...
定義 疊氮汞化aaidomercurati}n烯烴1 }I]疊氮化鈉2和醋酸 }3處理,發生疊氮汞化反應生成4,用硼氧化鈉還原可得5, 該是合成疊氮化合物的重要方法。 ...
疊氮化鉈,化學式TlN3,是一價鉈的疊氮酸鹽,有爆炸性。...... 中文名:疊氮化鉈 相對分子質量:246.43 英文名:Thallium(I) azide 化學品類別:無機物--鹽--鉈...
插入反應,具有特定結構的乃春也可以發生分子內的插入反應,例如疊氮甲酸酯在熱分解中生成取代氨基甲酸內酯,卡賓的跨環插入反應,也屬於分子內的插入反應。...
疊氮紅黴素是由半合成的十五員環內酯類抗生素組成的一種處方藥,主治呼吸道、泌尿道、皮膚軟組織感染及性病。...
疊氮基三甲基矽烷是一種化學物質,分子式是C3H9N3Si。...... 疊氮基三甲基矽烷其他信息 編輯 三甲基氯矽烷和迭氮化鈉在六甲基亞磷酸三醯胺中反應而得。...
利用傅立葉變換紅外光譜法(FTIR)分析了過氧化氫酶在溶液中的二級結構和過氧化氫酶與過氧化氫、疊氮化鈉以及梭曼作用後酶結構的不同改變,並比較了梭曼與細胞色素C...
