溶劑分解,有時也稱為溶解,為一吸引帶有分子離子溶劑的溶液聚集的過程。當離子在溶劑中溶解,且會被溶劑分子所包圍。
基本介紹
- 中文名:溶劑分解
- 外文名:Solvation
- 領域:工程
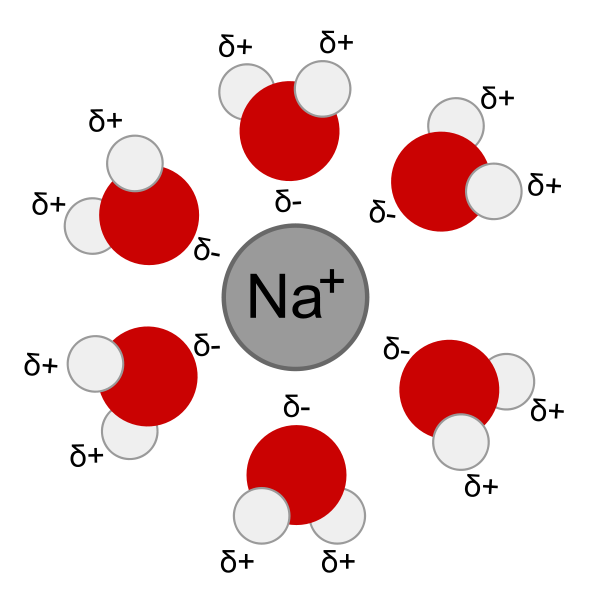
溶劑分解,有時也稱為溶解,為一吸引帶有分子離子溶劑的溶液聚集的過程。當離子在溶劑中溶解,且會被溶劑分子所包圍。
溶劑分解,有時也稱為溶解,為一吸引帶有分子離子溶劑的溶液聚集的過程。當離子在溶劑中溶解,且會被溶劑分子所包圍。...
溶劑降解sc}I}ent degradation溶劑指萃取劑和稀釋劑:在外界條件作用「,溶劑產生化學反應或分解稱為溶劑的降解,通常可分為化學降解和輻照降解兩種。化學降解是指溶劑...
溶劑法亦稱共沉澱法。將藥物與載體材料共同溶解於有機溶劑中,蒸去有機溶劑後使藥物與載體材料同時析出,即可得到藥物與載體材料混合而成的共沉澱物,經乾燥即得。...
化學分解發展歷史 編輯 其實在塗料工業和塗料科技的發展歷史中,甲醛一直扮演著十分重要的角色。甲醛可以作為塗料有機溶劑使用,有效的幫助塗料體系中基料/添加劑/填料...
溶劑解。溶質在溶液中與溶劑發生的復分解反應。如果在反應體系中只有底物和溶劑,沒有另加試劑,那么底物就將與溶劑發生反應,溶劑就成了試劑,這樣的反應稱為溶劑解...
同一溶劑中,不同的物質有不同的溶解度,同一物質在不同溶劑中的溶解度也不同。利用樣品中各組分在特定溶劑中溶解度的差異,使其完全或部分分離的方法即為溶劑...
市售的有機溶劑有工業、化學純和分析純等各種規格。在有機合成中,通常根據反應特性來選擇適宜規格的溶劑,以便使反應順利進行而又不浪費試劑。...
試樣分解是濕法分析中將試樣內的被測組分轉入適當溶液中的過程。 分解試樣時,應注意: ①分解試樣應合理地快而有效; ②不應腐蝕容器; ③不應引入會干擾以後...
溶劑合異構solvate isomeri。二化學組成相同的配位化合物,由於溶劑分子處於內界或外界的不同而引起的異構現象〔這些異構體在物理和化學性質上有顯著差異、肯見的為...
由於萃取劑與抗生素形成的複合物分子的疏水性比抗生素分子本身高的多,從而在有機相中有很高的溶解度。因此,在抗生素萃取中萃取劑又稱帶溶劑。 帶溶劑是指易溶於...
有機溶劑回收技術是工業上使用的有毒的有機溶劑回收的技術。...... 有機溶劑回收技術是工業上使用的有毒的有機...(氯對臭氧起催化分解作用),降低臭氧濃度,降低...
萃取,又稱溶劑萃取或液液萃取,亦稱抽提,是利用系統中組分在溶劑中有不同的溶解度來分離混合物的單元操作。即,是利用物質在兩種互不相溶(或微溶)的溶劑中溶解...
溶劑的溶解能力,簡單地說就是指溶解物質的能力,即溶質被分散和被溶解的能力。在水溶液中一般用溶解度來衡量,這隻適用於溶解低分子結晶化合物。對於有機溶劑的溶液...
溶解性是物質在形成溶液時的一種物理性質。它是指物質在一種特定溶劑里溶解能力大小的一種屬性。溶解度是指達到(化學)平衡的溶液便不能容納更多的溶質,是指物質...
分步萃取是利用系統中組分在溶劑中有不同的溶解度來分離混合物的單元操作,利用相似相溶原理。...
