基本介紹
- 中文名:沉澱
- 外文名:precipitation
- 反應:化學反應
- 原理:從過飽和溶液中析出的難溶物質
- 沉澱形式:一般為固相
- 學科:化學
科學術語
定義
原理
分類
製取
作用
種類
 氯化銀沉澱
氯化銀沉澱條件
金屬離子 | ||
開始沉澱 | 完全沉澱 | |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.7 | 4.7 |
Cu2+ | 4.4 | 6.4 |
Zn2+ | 6 | 8 |
Co2+ | 6.7 | 8.7 |
Fe2+ | 7.6 | 9.6 |
Mn2+ | 7.8 | 9.8 |
Mg2+ | 9.3 | 10.8 |
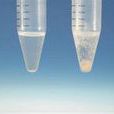
 氯化銀沉澱
氯化銀沉澱金屬離子 | ||
開始沉澱 | 完全沉澱 | |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.7 | 4.7 |
Cu2+ | 4.4 | 6.4 |
Zn2+ | 6 | 8 |
Co2+ | 6.7 | 8.7 |
Fe2+ | 7.6 | 9.6 |
Mn2+ | 7.8 | 9.8 |
Mg2+ | 9.3 | 10.8 |
沉澱,在化學上指從溶液中析出固體物質的過程;也指在沉澱過程中析出的固體物質。事實上沉澱多為難溶物(20°C時溶解度<0.01g)。在化學實驗和生產中廣泛套用沉澱...
共沉澱(coprecipitation),一種沉澱從溶液中析出時,引起某些共存的可溶性物質一起沉澱的現象。共沉澱是重量分析法誤差的主要來源之一,主要原因有表面吸附,混晶,包埋等...
沉澱(precipitation)是將溶液中的目的產物或主要雜質以無定形固相形式析出再進行分離的單元操作。 沉澱法有等電點沉澱法、鹽析法、有機溶劑沉澱法等。...
沉澱法,是指由於表面擴散脫氧法速度慢,故實際生產中使用並不廣泛,而常使用沉澱脫氧法。這種方法用磷、鋰作為脫氧劑,脫氧反應在整個熔池內進行,所以反應速度快。...
化學沉澱 chemical precipitation投加化學劑,使水中需要去除的溶解物質轉化為難溶物質而析出的水處理方法。用在給水處理中,用以去除鈣、鎂、鐵、錳等。廢水中的有...
沉澱劑一般分為無機沉澱劑和有機沉澱劑兩大類。使用無機沉澱劑進行沉澱分離,其分離效果和選擇性往往不如有機沉澱劑。經常採用的無機沉澱劑有氫氧化物沉澱法、草酸...
09快樂女生李霄雲的全新單曲《沉澱》首播。除此之外,2009快女十強合輯也在8月30日火熱出爐,與全國歌迷見面。...
區域沉澱(hindered sedimentation)又稱擁擠沉澱,成層沉澱,或干擾沉澱,它屬於沉澱類型中的一種,除此之外,還包括絮凝沉澱、自由沉澱和壓縮沉澱。當懸浮物濃度大於500 ...
後沉澱是由於沉澱速度的差異,而在已形成的沉澱上形成第二種不溶物質。...... 後沉澱,又叫繼沉澱,英文上稱作pastprecipitation,指沉澱操作中,當一種組分析出沉澱後...
繼沉澱(pastprecipitation)又稱為後沉澱,指溶液中某些組分析出沉澱之後,在放置的過程中,雜質離子慢慢沉澱到原沉澱上的現象。這種現象一般發生在該組分的過飽和溶液...
沉澱池是套用沉澱作用去除水中懸浮物的一種構築物,淨化水質的設備。利用水的自然沉澱或混凝沉澱的作用來除去水中的懸浮物。沉澱池按水流方向分為水平沉澱池和垂直...
顆粒在水中沉澱且沉澱速度不受干擾時,叫做自由沉澱(free sedimentation)。它屬於沉澱類型中的一種,除此之外,還包括絮凝沉澱、擁擠沉澱和壓縮沉澱。典型自由沉澱的例子...
一定溫度下,難溶電解質AmBn(s)難溶於水,但在水溶液中仍有部分An+和Bm-離開固體表面溶解進入溶液,同時進入溶液中的An+和Bm-又會在固體表面沉澱下來,當這兩個...
連續沉澱或稱連續脫溶,是指單相脫溶過程在母相中各處同時進行,這通常是在過飽和程度比較低的情況下發生,或者在沉澱相與母相錯配度比較大的合金中出現。...
資金沉澱常見於銀行和企業的說法,指的是在日常的資金流入流出過程中,賬戶中總留有一定數量的資金,這部分資金數量比較穩定,所以叫資金沉澱,是個形象的說法。就好像...
絮凝沉澱是顆粒物在水中作絮凝沉澱的過程。在水中投加混凝劑後,其中懸浮物的膠體及分散顆粒在分子力的相互作用下生成絮狀體且在沉降過程中它們互相碰撞凝聚,其尺寸...
沉澱資本是已經投資,形成固定資產且具有專有性的資產。...... 經濟學上有一個術語叫“沉澱資本”,意思是已經投資,形成固定資產且具有專有性的資產。這部分資產形成...
沉澱物,在化學上指從溶液中析出固體物質的過程;也指在沉澱過程中析出的固體物質。事實上沉澱多為難溶物(20°C時溶解度<0.01g)。在化學實驗和生產中廣泛套用沉澱...
沉澱強化,即指材料強度在時效溫度下隨時間而變化的現象,是鋁合金和高溫合金的主要強化手段,其基本條件是固溶度隨溫度下降而降低。它是提高材料強度的最有效的辦法,...
沉澱資金指閒散放置在社會上,未被聚積起來加以利用的資金。沉澱資金也可以指折舊基金在固定資產更新期限到來之前處於生產過程之外的一種“閒置資金”。...
沉澱原理是利用油和雜質的不同密度,藉助策略的作用,達到自然分離才者的一種方法。 污水中的懸浮物質,可以在重力作用下沉澱去除。這是一種物理過程,簡便易行,效果...
懸浮顆粒濃度不高;沉澱過程中懸浮固體之間互不干擾,顆粒各自單獨進行沉澱, 顆粒沉澱軌跡呈直線。沉澱過程中,顆粒的物理性質不變。發生在沉砂池中。...
《沉澱下來的心》是連載於晉江文學城的網路小說,作者是冰冷心。...... 《沉澱下來的心》是連載於晉江文學城的網路小說,作者是冰冷心。中文名 沉澱下來的心 作者...
沉澱速度,是指在離心力的作用下,物質粒子在單位時間內沿離心力方向移動的距離。沉澱係數是指在單位離心場中顆粒的沉澱速度,受介質(溶劑)密度和粘度的影響。單個...
