平衡電極電位,也稱可逆電極的電位。在一個可逆電極中,金屬成為陽離子進入溶液以及溶液中的金屬離子沉積到金屬表面的速度相等時,反應達到動態平衡,亦即正逆過程的物質遷移和電荷運送速度都相同,此時該電極上的電位值稱為平衡電極電位。
基本介紹
- 中文名:平衡電極電位
- 外文名:Equilibrium electrode potential
- 別名:可逆電極電位
- 適用:可逆電極
- 公式:能斯特方程
- 學科:化學
簡要介紹
平衡電極電位與能斯特方程

金屬的電動順序
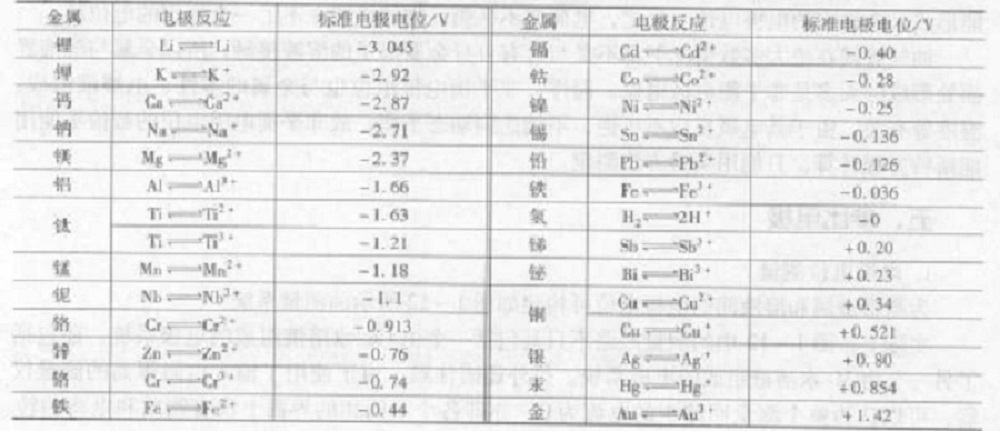 金屬的電動順序
金屬的電動順序能斯特方程




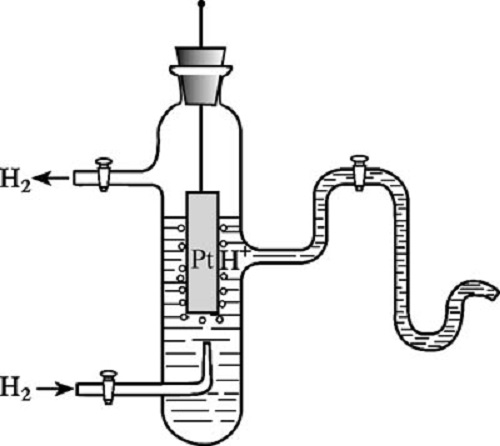
平衡電極電位,也稱可逆電極的電位。在一個可逆電極中,金屬成為陽離子進入溶液以及溶液中的金屬離子沉積到金屬表面的速度相等時,反應達到動態平衡,亦即正逆過程的物質遷移和電荷運送速度都相同,此時該電極上的電位值稱為平衡電極電位。

 金屬的電動順序
金屬的電動順序



平衡電極電位,也稱可逆電極的電位。在一個可逆電極中,金屬成為陽離子進入溶液以及溶液中的金屬離子沉積到金屬表面的速度相等時,反應達到動態平衡,亦即正逆過程的物質...
平衡電位(equilibrium potential)指靜息條件下細胞膜內外的電位差。細胞膜內外的鉀離子濃度內高外低,存在濃度梯度,而細胞膜可允許鉀離子透出膜外。當鉀離子外移開始...
標準電極電位,即標準電極電勢,指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。非標態下的標準電極電位可由能斯特方程導出。...
當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位,叫做標準電極電位。 [1] 電極電位物理套用 編輯 判斷氧化還原反應自發進行的方向...
電極電位金屬浸於電解質溶液中,顯示出電的效應,即金屬的表面與溶液間產生電位差,這種電位差稱為金屬在此溶液中的電位或電極電位。...
電極在有電流通過時所表現的電極電勢與可逆電極電勢產生偏差的現象稱為電極極化。電極極化的特徵是:陰極電位比平衡電位更負(陰極極化),陽極電位比平衡電位更正(陽極...
電極學是電化學的一個分支,它研究電極的各種平衡性質和動態行為。電極學主要講述電極學基礎、電極反應熱力學,電極過程動力學和電極反應工程學。...
一種氣體電極,如果以空氣代替氧,即為空氣電極。電極反應為2H2O+O2+4e-=4OH-,但此反應不易達平衡,故可逆氧電極難於實現。氧電極在電解水製取氧氣,研製氫/氧...
過電位(英語:overpotential)是電極的電位差值。又叫超電勢。為一個電極反應偏離平衡時的電極電位與這個電極反應的平衡電位的差值,無電流通過(平衡狀態下)和有電流...
當電池有電流通過,使電位偏離了平衡電位的現象,稱為電極極化。過電勢就是實際電勢與平衡電勢的差值,被用來衡量極化的程度。電池極化現象在常見電池如鉛酸電池、鋰...
2、電化學極化:由於電極反應速度有限造成電極上帶電程度與平衡時不同,而導致有電流通過時的電極電位值偏離平衡時的電極電位的現象,叫電化學極化。...
電流通過電極時,電極電勢偏離平衡電極電勢的現象稱為電極的極化。極化導致電池在接入電路以後正負極間電壓的降低,也導致電鍍和電解槽在開始工作以後所需電壓的升高。...
② 電流通過電池或電解池時,如整個電極過程為電解質的擴散和對流等過程所控制,則在兩極附近的電解質濃度與溶液本體就有差異,使陽極和陰極的電極電位與平衡電極電位...
電池的開路電壓等於電池在斷路時(即沒有電流通過兩極時)電池的正極電極電勢與...開路電月有質的區別,電動勢是兩極平衡電位之差,開路電壓是正負兩極穩定電位之差...
