簡介
六元環是自然界中發現最多的環系,這是因為六元環以十分穩定的構象形式存在。在這個構象中,基本上不存在任何
角張力和
扭轉張力。下圖以兩種不同的方式表示了環己烷的這一穩定構象。
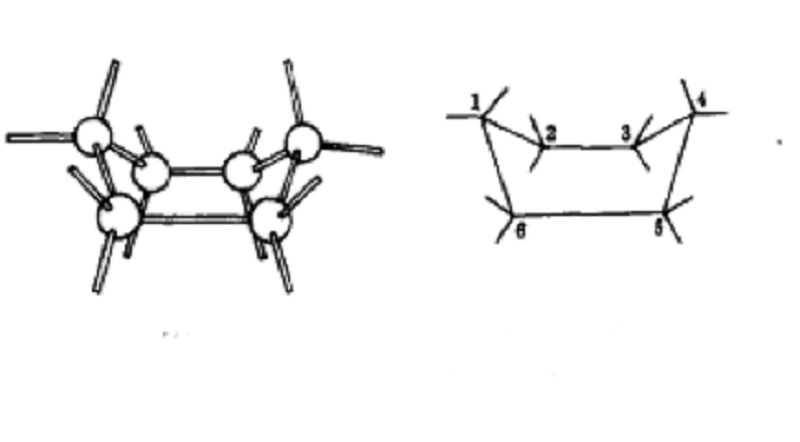
 環已烷的椅型構象
環已烷的椅型構象從中間的式子容易看出C
2、C
3、C
5和C
6構成了一個平面,類似一張椅子面。C
1朝下,類似椅子腿,C
4朝上類似椅子靠背。因此該
構象被形象地稱為椅型構象(chair conformation)。
環己烷的椅型構象中,所有C—C—C鍵角均為111°,與sp3雜化軌道夾角109.5°十分接近,基本上沒有角張力。用Newman投影式表示這一構象,可以清楚地觀察到椅型構象中任意兩個相鄰碳原子的構象全部為交叉式。因此也不存在扭轉張力。
球棍模型
仔細觀察環己烷椅型構象的球棍模型,可以觀察到另外兩個相互平行的平面,即C1、C3和C5組成的下平面以及C2、C4和C6組成的上平面,如下圖所示。
 球棍模型
球棍模型以這兩個平面為基準,可以看到下平面碳原子上向下的鍵垂直於該平面向下,而上平面碳原子上向上的鍵垂
直於該平面向上,因此稱之為直立鍵,也稱為a鍵(axial bonds)。其餘的鍵則平伏伸向環的兩側,因此稱之為平伏鍵,也稱為e鍵(equatorial bonds)。
為了清晰準確地表達環己烷椅型構象中a、e鍵的關係,畫椅型構象時,不能將椅子面畫成水平面(如下圖中左圖所示),而應將奇數碳或偶數碳構成的平面作為水平面(如下圖中右圖所示)。
 環己烷椅型構象的兩種畫法對比
環己烷椅型構象的兩種畫法對比穩定形式
除D3d對稱性的椅型構象(1)外環己烷還有半椅型/信封型(2)、扭船型(3、5,D2對稱性)和船型(4)等構象,但只有這之中扭船型可以和椅型一樣分離出來(因它為能量低點)。船型結構無
角張力,但有兩個軸向1,4-氫間的空間張力(即所謂旗桿氫作用),而且因兩根碳-碳鍵處於重疊構象,所以也有扭轉張力,不如椅型構象穩定。船型結構可以折成其他構象以減少張力,如比它更加穩定的扭船型。
 構象
構象船型和半椅型構象分別是扭船型間和扭船-船型間的過渡態,無法分離出來。相對船型,扭船型、船型和半椅型的能量分別為23、28、45 kJ/mol。環翻轉實際上就是經過兩個半椅型、兩個扭船型和一船型構象,從一椅型翻到另一椅型的過程。椅型和扭船型間的能差可通過對正逆轉化反應的活化能求差而間接求得。室溫下只有很少(<0.1%)的環己烷是以扭船型存在的,但在800℃時該比例可以增至30%。可藉此對正反應進行研究,同樣將1073K的環己烷迅速冷卻到40K,用
紅外光譜研究,就可以得到相應的逆反應數據。
 構象活化能
構象活化能 環已烷的椅型構象
環已烷的椅型構象 球棍模型
球棍模型 環己烷椅型構象的兩種畫法對比
環己烷椅型構象的兩種畫法對比 構象
構象 構象活化能
構象活化能