基本介紹
- 中文名:構象分析
- 定義:物理有機化學的一個重要概念
- 創立人:Derek Barton
- 介紹:英國化學家
- 分析:能量最小的構象是分子保持的構象
- 特點:兩構象異構體差3kcal/mol的能量
概念介紹
創立
乙烷構象分析
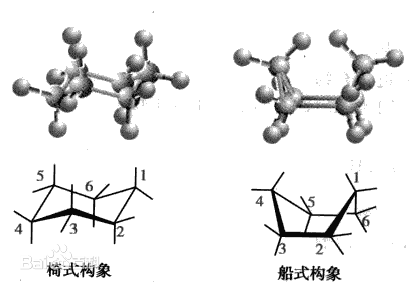
環己烷構象分析

構象分析,物理有機化學的一個重要概念。最簡單的構象分析建立在乙烷分子上。最重要的構象分析則是建立在環己烷上的構象分析。它由英國化學家Derek Barton首先系統地...
構象(conformation),有機化學的一個重要概念。最簡單的構象分析建立在乙烷分子上。最重要的構象分析則是建立在環己烷上的構象分析。...
構象分析,物理有機化學的一個重要概念。最簡單的構象分析建立在乙烷分子上。最重要的構象分析則是建立在環己烷上的構象分析。...
單鏈構象多態性(single strand conformation polymorphism,SSCP)分析是利用DNA或RNA單鏈構象具有多態性的特點,結合PCR技術進行基因檢測的一種分析技術,稱為PCR-SSCP...
即構象翻轉,由C-C單鍵的旋轉而導致。構象(conformation),有機化學的一個重要概念。最簡單的構象分析建立在乙烷分子上。最重要的構象分析則是建立在環己烷上的構象...
構型一定的分子有無窮個構象,只有在圍繞分子內單鍵旋轉過程中,位於能量——旋轉角度曲線上各極小值處的那些構象,稱為構象異構體,簡稱異象體(conformer)。有時亦稱...
結構分析亦稱“比重分析”。計算某項經濟指標各項組成部分占總體的比重,分析其內容構成的變化,從結構分析中,掌握事物的特點和變化趨勢的統計分析方法。如按構成流動...
反式構象構象和構象分析 編輯 構象:沿C-C單鍵旋轉,分子產生不同形象,稱為構象。單鍵旋轉能壘一般為3~10千卡/摩爾,在室溫下熱運動可以越過此能壘,各種構象...
結構分析法是指對經濟系統中各組成部分及其對比關係變動規律的分析。如國民生產總值中三種產業的結構及消費和投資的結構分析、經濟成長中各因素作用的結構分析等。結構...
單鍵旋轉時,相鄰碳上的其他鍵會交叉成一定的角度,稱為扭轉角(torsionangle)。扭轉角是0°的構象為重疊構象,扭轉角是60°的構象是交叉構象,扭轉角在0-60°之間...
結構分析方法是通過分析和確立事物(或系統)內部各組成要素之間的關係及聯繫方式進而認識事物(或系統)整體特性的一種科學分析方法。任何客觀事物都是具有一定結構的整體...
環己烷從一種椅式構象變成另一種椅式構象可以經過船式構象或者扭船式構象和半椅式構象。其穩定性低於船式和椅式。...
晶體結構分析晶體結構分析 編輯 晶體學中的一個重要的領域,它研究晶態物質內部在原子尺度下的微觀結構。它為固體物理學、材料科學、結構化學、分子生物學、礦物學、...
結構性分析(structuralanalysis)是指對經濟系統中各組成部分及其對比關係變動規律的分析。如國民生產總值中三次產業的結構及消費和投資的結構分析、經濟成長中各因素...
單鍵旋轉時,相鄰碳上的其他鍵會交叉成一定的角度,稱為扭轉角(torsionangle)。扭轉角是0°的構象為重疊構象,扭轉角是60°的構象是鄰位交叉構象,也叫順錯構象,...
結構化分析(Structured Analysis,簡稱SA)是軟體工程中的一種方法,結構化分析和結構化設計可以分析商業的需求,再轉換為規格檔案,最後再產生電腦軟體、硬體配置及相關的...
《有機化合物結構分析》是 2011年1月18日科學出版社出版的圖書,作者是鄒建平。...... 《有機化合物結構分析》介紹了有機化合物的分離與純化方法、有機化合物的...
單鍵旋轉時,相鄰碳上的其他鍵會交叉成一定的角度,稱為扭轉角(torsionangle)。扭轉角是180o的構象是對位交叉構象,0°的構象為重疊構象,扭轉角是60°的構象是鄰...
SA方法是結構化分析(Structured Analysis)的簡稱,它是典型的面向數據流的分析方法。由於其簡單易懂,即可以用手工方式實現,也適用於自動化、半自動化分析工具,因此...
單鍵旋轉時,相鄰碳上的其他鍵會交叉成一定的角度,稱為扭轉角(torsionangle)。扭轉角是0°的構象為重疊構象,扭轉角是180°的構象為反向構象,扭轉角是60°的構象...
波譜分析主要是以光學理論為基礎,以物質與光相互作用為條件,建立物質分子結構與電磁輻射之間的相互關係,從而進行物質分子幾何異構、立體異構、構象異構和分子結構分析和...
單鍵旋轉時,相鄰碳上的其他鍵會交叉成一定的角度,稱為扭轉角(torsionangle)。扭轉角是0°的構象為重疊構象,扭轉角是60°的構象是鄰位交叉構象,也叫順錯構象,...
中文名稱 結構矩陣分析法 英文名稱 matrix analysis of structure 定義 用矩陣表示結構的基本量和基本方程,並用矩陣進行推演運算的結構力學分析方法。 套用學科 ...
