基本介紹
- 中文名:相對揮發度
- 外文名:relative volatility
- 性質:揮發度
- 屬性:相對
- 成平衡的:液相中兩組分摩爾分數比的α倍
概念

具體推導



 相對揮發度
相對揮發度 相對揮發度
相對揮發度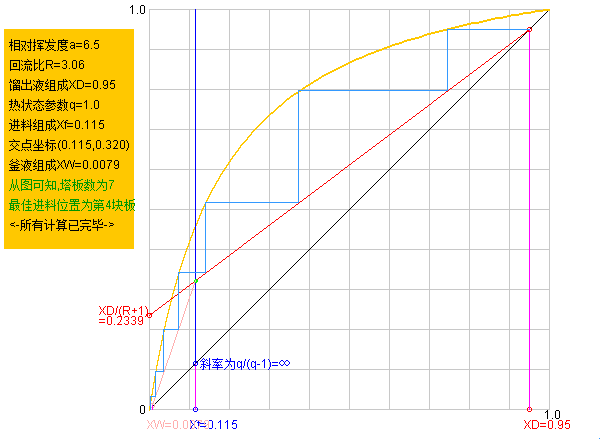




 相對揮發度
相對揮發度 相對揮發度
相對揮發度相對揮發度是指溶液中易揮發組分的揮發度對難揮發組分的揮發度之比,以α表示。它表示氣相中兩組分的摩爾分數比為與之成平衡的液相中兩組分摩爾分數比的α倍。...
具有較高蒸氣壓的物質稱做易揮發物(volatile matter);較低的稱做難揮發物(involatile matter)。對於組分互溶的混合液,兩組分的揮發度之比稱做相對揮發度(...
最小回流比不僅取決於分離要求,還與料液的相對揮發度和料液組成以及進料的熱狀態有關。對於相對揮發度在全塔接近常數的料液的分離,最小回流比[cdhmin]可由下列...
(2)套用相平衡關係,計算第一塊板流下的液相組成,如果已知各組分的全塔平均相對揮發度數據,則有: ;(3)利用精餾操作線方程計算第二塊板上升汽相組成: ;...
二、揮發度和相對揮發度 三、非理想溶液 第二節 蒸餾方式 一、簡單蒸餾 二、平衡蒸餾 三、平衡級蒸餾和精餾原理 第三節 二元連續精餾的分析和計算 一、全塔物...
若知道相對揮發度α的數值,由相平衡方程即可得到氣液平衡時易揮發組分濃度(y—x)的對應關係。詞條標籤: 數學, 學科 V百科往期回顧 詞條統計 瀏覽次數:次 編輯...
1、定義: 餾出液中除了重關鍵組分外沒有其它重組分,而釜液中除了重輕關鍵組分外沒有其它輕組分。 2、什麼情況下可以達到清晰分割: 兩個關鍵組分的相對揮發...
Feriske方程Fenske ecluati}n 1932年M.R.Fenske推 導出-1相對揮發度a為恆定時,計算二元精餾所需的最小理 論塔板數。...
與傳統的加水、加有機溶劑提高相對揮發度措施相比,鹽離子對溶液組分間的相對揮發度的影響要遠大於前兩者,因此,溶鹽精餾具有低能耗的顯著特徵。溶鹽精餾雖能有效...
用反應促進精餾,就是在混合物中加入一種能與被分離組分發生可逆化學反應的物質(第三組分),以提高其相對揮發度,使精餾容易進行。如在混合二甲苯中加入異丙苯鈉,...
而在100℃時,水的飽和蒸氣壓增大到101324.72Pa,乙醇為222647.74Pa。飽和蒸氣壓是液體的一項重要物理性質,液體的沸點、液體混合物的相對揮發度等都與之有關。...
氣提法是利用待測組分揮發度大的特性,或將欲測組分轉變成易揮發性物質,然後用惰性氣體帶出面達到了分離富集的目的。...
分離的難度取決於組分的相對揮發度。混合物中組分的濃度以及所要求的餾出液純度。被蒸餾物的數量必須與分餾柱的大小相適應。按照一一般的規則,要求分離為純品的...
閃蒸是單平衡級的蒸餾過程,易揮發的組元在氣相中富集,重組元則較多地留在液相中,除非相對揮發度較大,單平衡級組元的分離程度一般都比較差,所以閃蒸常作為輔助...
裂解氣深冷分離是裂解氣分離的重要方法之一,因過程採用了-100℃以下的低溫冷凍系統,所以稱深冷。原理是利用裂解氣中各種烴的相對揮發度不同,在低溫下把氫氣以外的...
因進料粘度與丙烯一丙烷相對揮發度乘積小於0.1,超出奧康奈爾經驗關係曲線的使用範圍,其經驗關係曲線不適用於丙烯精餾塔。文獻r90通過大量的模擬計算,推薦丙烯一丙烷...
精餾是利用混合物中各組分揮發度不同而將各組分加以分離的一種分離過程,常用的設備有板式精餾塔和填料精餾塔。精密精餾的原理及設備流程與普通精餾相同,只是待...
這兩個組分中揮發度較大者稱為輕關鍵組分,揮發度較小者稱為重關鍵組分。式(4-71)中的相對揮發度alh可取為塔頂、進料和塔釜三處相對揮發度的幾何平均值,也...
其中化學淨化過程利用鹼液脫除尾氣中的酸性氣體( CO2、NO2 ) ,吸附單元利用分子篩物理吸附脫除C2H2、NO、CO、H2O等雜質,最後利用精餾單元脫除其他相對揮發度大的組...
即在雙組份異 構體混合物中,加入第三成份(反應性夾帶劑),然後在蒸餾塔中通過反應性夾帶劑與異構體的某一組份發生反應而加大與另一組份的相對揮發度,從而得...
使用溶劑能夠降低能耗,增加了相對揮發度,進而提高精製效果。根據計算,這種分離方法只需很少的理論塔板數,大大減少能耗,降低成本。 蒽化學法 化學法利用粗蒽中蒽、...
Δ---兩欲分離組分的沸點差(ΔT),或者Δ=(α-1)×100,α為這兩種欲分離組分的相對揮發度(分離因子)。V百科往期回顧 詞條統計 瀏覽次數:次 編輯次數:3次...
對於各組分揮發度相等或相近的混合液,為了增加各組分間的相對揮發度,可以在精餾分離時添加溶劑或鹽類,這類分離操作稱為特殊蒸餾,其中包括恆沸精餾、萃取精餾和加鹽...
物系中加入共沸劑(或者稱共沸組分),該共沸劑必須能和物系中一個或幾個組分形成具有最低沸點的恆沸物,以至於使需要分離的集中物質間的沸點差(或相對揮發度)...
如果雙組分溶液A、B的相對揮發度很小,或具有均相恆沸物,此時可加入某種添加劑C進行精餾。這裡C又稱挾帶劑。它與原溶液中的一個或兩個組分形成新的恆沸物(...
