基本介紹
- 中文名:成鍵軌道
- 外文名:bonding orbital
- 對應項:反鍵分子軌道
- 特性:能量較組合前原子軌道更低
- 套用學科:化學(一級學科)
- 位置幾率:兩原子核間幾率密度最大
定義
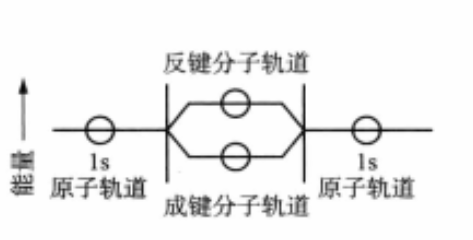 氫原子軌道和分子軌道能量關係示意圖
氫原子軌道和分子軌道能量關係示意圖分類
σ成鍵軌道
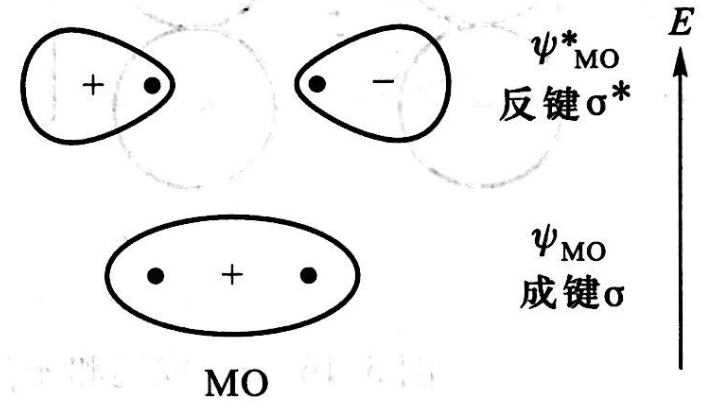 σ成鍵軌道
σ成鍵軌道π成鍵軌道
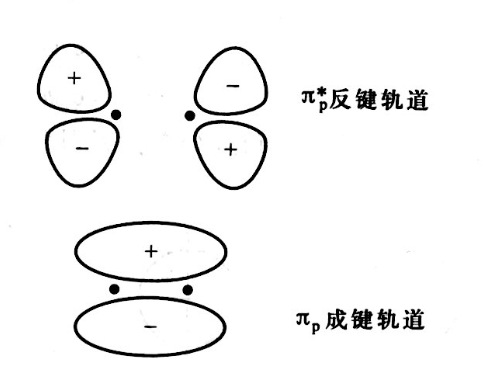 π成鍵軌道
π成鍵軌道軌道形成三原則
對稱性一致原則
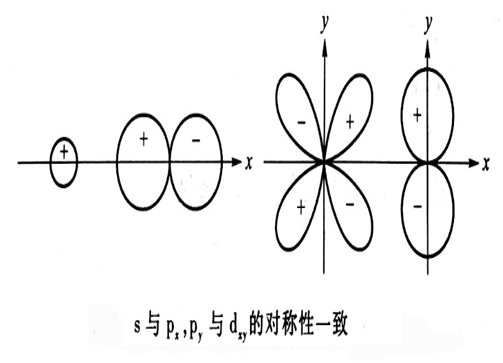 對稱性一致
對稱性一致能量相近原則
 第一電離能
第一電離能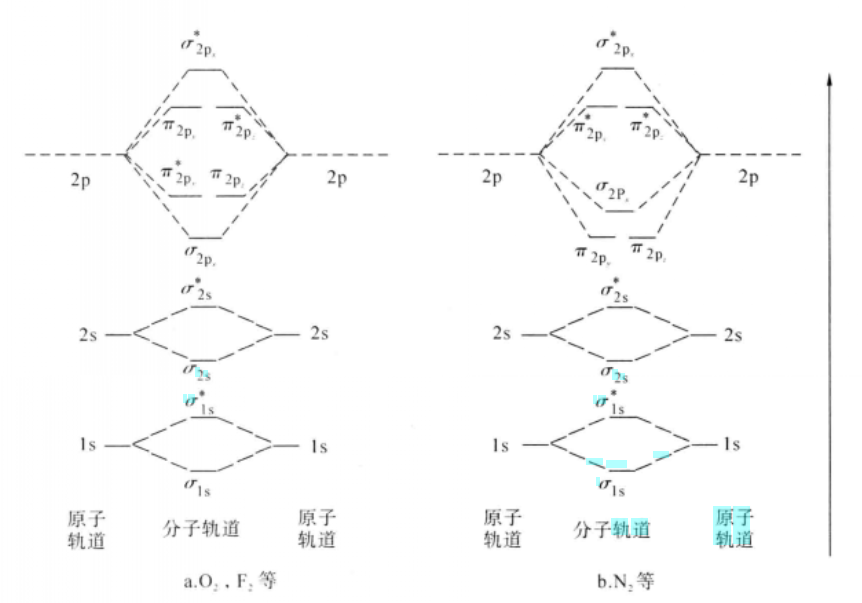
 氫原子軌道和分子軌道能量關係示意圖
氫原子軌道和分子軌道能量關係示意圖 σ成鍵軌道
σ成鍵軌道 π成鍵軌道
π成鍵軌道 對稱性一致
對稱性一致 第一電離能
第一電離能成鍵軌道是分子軌道理論中的的一個化學概念。分子軌道是由原子軌道的線性組合而成,分子中的電子圍繞整個分子運動,其波函式稱為分子軌道。分子軌道由原子軌道線性組合...
分子軌道(MO)可用原子軌道線性組合。是可以通過相應的原子軌道線性組合而成。有幾個原子軌道相組合,就形成幾個分子軌道。在組合產生的分子軌道中,能量低於原子軌道的...
分子軌道法是在1932年提出的,它從分子的整體出發去研究分子中每一個電子的運動狀態,認為形成化學鍵的電子是在整個分子中運動的。通過薛丁格方程的解,可以求出描述...
雜化軌道理論(Hybrid Orbital Theory)是1931年由鮑林(Pauling L)等人在價鍵理論的基礎上提出,它實質上仍屬於現代價鍵理論,但是它在成鍵能力、分子的空間構型等方面...
分子軌道理論又稱分子軌道法(Molecular Orbital Theory)或MO法,1932年由美國化學家馬利肯(R.S.Mulliken)及德國物理學家洪特(F.Hund)提出。是現代共價鍵理論之一...
需要指出:氫鍵雖然存在軌道重疊,但通常不算作共價鍵,而屬於分子間作用力。共價鍵與離子鍵之間沒有嚴格的界限,通常認為,兩元素電負性差值大於1.7時,成離子鍵;小於1...
軌道重疊其實是分子中的原子的原子軌道線性組合,原子軌道相加形成成鍵軌道,原子軌道相減形成反鍵軌道,電子填充在了成鍵軌道上體系能量下降。原子軌道重疊後,就形成分子...
軌道雜化概念,是由美國化學家鮑林在1931年首先提出的,經過不斷深化和完善,現已成為當今化學鍵理論的重要內容之一。...
1、 某原子在成鍵時,在鍵合原子的作用下,同一原子中不同類型能量相近的原子軌道可能改變原有的狀態,混雜起來並重新組合成一組有利於成鍵的新軌道(即雜化軌道)...
MO,是分子軌道理論(molecular orbital theory)的簡稱,是1932年美國化學家 Mulliken RS和德國化學家Hund F 提出的一種新的共價鍵理論。...
前線分子軌道理論,簡稱“前線軌道理論”。解釋化學中成鍵規律的定性理論。是日本化學家福井謙一於1952年提出。...
原子軌道沿鍵軸(兩原子核間連線)方向以“頭碰頭”方式重疊所形成的共價鍵稱為σ 鍵。形成σ鍵時,原子軌道的重疊部分對於鍵軸呈圓柱形對稱,沿鍵軸方向旋轉任意...
原子軌道垂直於鍵軸以“肩並肩”方式重疊所形成的化學鍵稱為π 鍵。形成π 鍵時,原子軌道的重疊部分對等地分布在包括鍵軸在內的平面上、下兩側,形狀相同,符號...
鍵級又稱鍵序,是分子軌道法中表示相鄰的兩個原子成鍵強度的一種數值。對雙原子分子來說,把成鍵電子數與反鍵電子數的差值的一半,稱為鍵級。在形成共價鍵時,成...
δ鍵 由兩個相同或不同的原子的價電子沿著軌道對稱軸方向相互重疊所形成的鍵叫δ鍵。化學中,δ鍵(Delta鍵)是共價鍵的一種,由兩個d軌道四重交疊而成。δ鍵...
在多原子分子中如有相互平行的p軌道,它們連貫重疊在一起構成一個整體,p電子在多個原子間運動形成π型化學鍵,這種不局限在兩個原子之間的π鍵稱為離域π鍵,或...
1949年,Bjorksten和Lyaeger共同提出化學鍵理論。關於分子(或晶體)內相鄰原子(或...為原子軌道。(2)分子中每個電子看成是在核與其他電子組成的平均勢場中運動,每個...
