形成條件
為了原子軌道的有效重疊,參與重疊的原子軌道必須滿足:
1、能量近似原則,即參與重疊的原子軌道的能量要相近;
2、對稱性原則,即參與重疊的原子軌道,對稱性要匹配;
例如:pz原子軌道與另1個原子的px原子軌道對稱性相符,但px與py或pz原子軌道對稱性不相符,不能有效重疊;
3、軌道最大重疊原則,即參與重疊的原子軌道在可能的情況下,採用波函式角度部分最大處重疊。這三個原則,通常稱為共價鍵的成鍵三原則。
現以HCl為例,說明這成鍵三原則的套用。H原子與C1原子的電子層結構分別為:H1s2;Cl1s22s22p63s2
3p5。根據H與Cl的第一電離能,可知H的1s原子軌道與Cl的3p原子軌道能量近似。Cl的3p5電子狀態為:
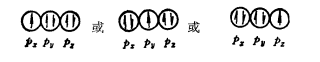 Cl的3p5電子狀態
Cl的3p5電子狀態假定H與Cl兩原子核的連線直線ab為鍵軸並定為原子軌道重疊的z軸,如下圖:
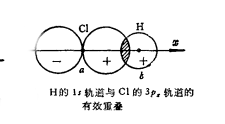 H的1s原子軌道與Cl的3Px的原子軌道有效重疊
H的1s原子軌道與Cl的3Px的原子軌道有效重疊顯然Cl的3Px電子的原子軌道才能與H的1s原子軌道的對稱性相符,才能有效重疊。其它3py或3pz原子軌道,因它們的對稱軸為y或z軸與x軸不同,對稱性不符,故不能有效重疊。H的1s原子軌道沿x軸重疊才能達到最大重疊,故HCl的共價鍵是由s-px形成的。
分類
正重疊:當兩個原子軌道的角度部分以同符號(即“+”與“+”或“-”與“-”)相重疊時,系統能量降低能夠成鍵,故此正重疊為有效重疊。
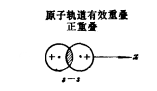 正重疊
正重疊負重疊:當兩個原子軌道的角度部分以不同符號(即“+”與“-”)相重疊時,系統能量升高,不能成鍵,故此負重疊為非有效重疊。
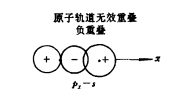 負重疊
負重疊零重疊:當兩個原子軌道的角度部分,一部分以同符號重疊,另一部分以不同符號重疊,兩者重疊部分正好抵消,系統能量沒有降低,也不能成鍵,也屬非有效重疊
解釋共價鍵形成
價鍵理論(valence bond theory,簡稱VB理論)用原子軌道重疊概念解釋共價鍵的形成,如下圖示意A原子一條s軌道與B原子一條s軌道的重疊。
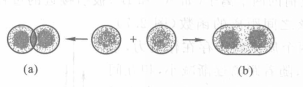 (a)原子軌道重疊;(b)分子軌道
(a)原子軌道重疊;(b)分子軌道發生重疊的可以是各填有一個電子的兩個軌道,也可以是一條滿軌道與一條空軌道。前一種情況形成一般意義的共價鍵,後一種情況則形成配位共價鍵。形象地說,軌道重疊意味著兩核之間的重疊部分具有較大的電子密度,共價作用力的實質被解釋為核間較大的電子密度對兩核的吸引力。軌道重疊程度越大,核間的電子密度越大,形成的共價鍵越強,由共價鍵結合的分子越穩定。
方向性:形成共價鍵時,原子軌道總是儘可能沿著電子出現機率最大的方向重疊以儘量降低系統的能量。正是原子軌道在核外空間的取向和軌道重疊方式的要求決定了共價鍵具有方向性。
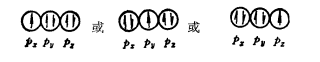 Cl的3p5電子狀態
Cl的3p5電子狀態 H的1s原子軌道與Cl的3Px的原子軌道有效重疊
H的1s原子軌道與Cl的3Px的原子軌道有效重疊 正重疊
正重疊 負重疊
負重疊 (a)原子軌道重疊;(b)分子軌道
(a)原子軌道重疊;(b)分子軌道