分子軌道的歷史 1927年,我們所熟知的
價鍵理論 被提出,隨後,受到洪特,馬利肯,斯萊德和John Lennard-Jones的影響,分子軌道開始產生。因此,在最初的時候,分子軌道理論被稱為洪特-馬利肯理論。而“軌道”一詞的概念則是在1932年首先被馬利肯提出。
到了1933年,分子軌道理論已經被廣泛的接受,並且被認為是一個有效而且有用的理論。事實上,根據德國物理化學家
休克爾 的描述,第一篇使用分子軌道理論的文獻是由萊納德瓊斯發表於1929年。而第一個使用分子軌道理論的定量計算文獻則是在1938年由庫爾森發表的使用自洽場理論解決氫分子的電子波函式的工作。
到1950年,分子軌道徹底被定義為自洽場哈密頓算符的
本徵函式 ,這就是分子軌道理論發展成為一個嚴謹科學理論的標誌。HF方法(Hartree-Fock method)是分子軌道理論的一種比較嚴謹的處理方法,儘管在一開始,HF方法是用來計算原子的電子結構的一種方法,但是在分子計算當中,分子軌道按照原子軌道的一組基集被拓展,發展出羅特漢方程,以此為基礎,又發展出了各種各樣的從頭算量子化學計算方法。與此同時,分子軌道理論也被套用在了一種採用了更多近似方法的半經驗計算當中,被稱為半經驗量子化學計算方法。
理論簡介 一種
化學鍵 理論,是原子軌道理論對分子的自然推廣。其基本觀點是:物理上存在單個電子的自身行為,只受分子中的原子核和其他電子平均場的作用,以及
泡利不相容原理 的制約;數學上則企圖將難解的多電子運動方程簡化為單電子方程處理。因此,分子軌道理論是一種以
單電子近似 為基礎的化學鍵理論。描寫單電子行為的
波函式 稱軌道(或軌函),所對應的單電子能量稱
能級 。對於任何分子,如果求得了它的系列分子軌道和能級,就可以像討論
原子結構 那樣討論分子結構,並聯繫到分子性質的
系統解釋 。有時,即便根據用粗糙的計算方案所得到的部分近似分子軌道和能級,也能分析出很有用處的定性結果。
軌道簡介 1、原子在形成分子時,所有電子都有貢獻,分子中的電子不再從屬於某個原子,而是在整個分子空間範圍內運動。在分子中電子的空間
運動狀態 可用相應的分子軌道
波函式 ψ(稱為分子軌道)來描述。分子軌道和原子軌道的主要區別在於:
(1)在原子中,電子的運動只受1個原子核的作用,
原子軌道 是單核系統;而在分子中,電子則在所有原子核勢場作用下運動,分子軌道是多核系統。
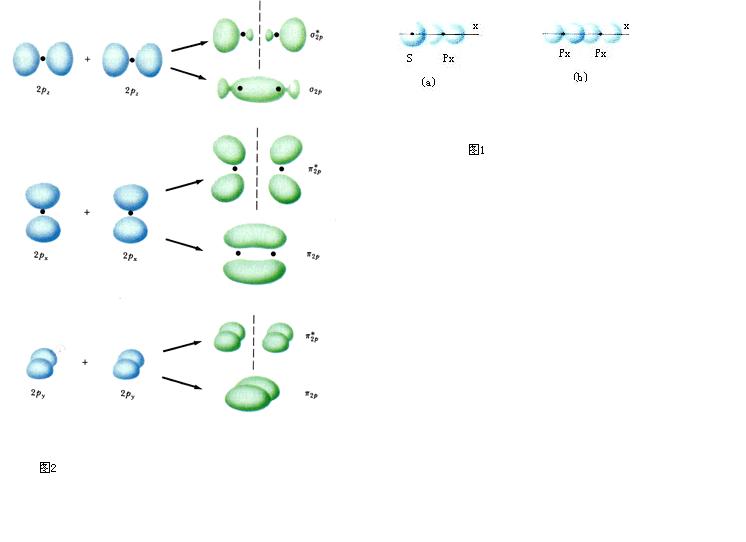
(2)原子軌道的名稱用s、p、d…符號表示,而分子軌道的名稱則相應地用σ、π、δ…符號表示。
分子軌道理論 2、分子軌道可以由分子中原子軌道波函式的線性組合(linear combination of atomic orbitals,LCAO)而得到。有幾個原子軌道就可以可組合成幾個分子軌道,其中有一部分分子軌道分別由對稱性匹配的兩個原子軌道疊加而成,兩核間電子的機率密度增大,其能量較原來的原子軌道能量低,有利於成鍵,稱為成鍵分子軌道(bonding molecular orbital),如σ、π軌道(軸對稱軌道);同時這些對稱性匹配的兩個原子軌道也會相減形成另一種分子軌道,結果是兩核間電子的機率密度很小,其能量較原來的原子軌道能量高,不利於成鍵,稱為反鍵分子軌道(antibonding molecular orbital),如 σ*、π* 軌道(
鏡面對稱 軌道,反鍵軌道的符號上常加“*”以與
成鍵軌道 區別)。還有一種特殊的情況是由於組成分子軌道的
原子軌道 的空間對稱性不匹配,原子軌道沒有有效重疊,組合得到的分子軌道的能量跟組合前的原子軌道能量沒有明顯差別,所得的分子軌道叫做非鍵分子軌道。
3、電子在分子軌道中的排布也遵守原子軌道電子排布的同樣原則,即Pauli不相容原理、
能量最低原理 和Hund規則。具體排布時,應先知道分子軌道的
能級 順序。當前這個順序主要藉助於
分子光譜 實驗來確定。
線性組合原則 原子軌道組合形成分子軌道時所遵從的能量近似原則、對稱性匹配原則和軌道最大重疊原則稱為成鍵三原則。
對稱性匹配原則 只有
對稱性 匹配的原子軌道才能組合成分子軌道,這稱為對稱性匹配原則。原子軌道有s、p、d等各種類型,從它們的角度分布函式的
幾何圖形 可以看出,它們對於某些點、線、面等有著不同的空間對稱性。對稱性是否匹配,可根據兩個原子軌道的角度分布圖中波瓣的正、負號對於鍵軸(設為x軸)或對於含鍵軸的某一平面的對稱性決定。
能量近似原則 在
對稱性 匹配的原子軌道中,只有能量相近的原子軌道才能組合成有效的分子軌道,而且能量愈相近愈好,這稱為能量近似原則。
軌道最大重疊原則 對稱性匹配的兩個
原子軌道 進行線性組合時,其重疊程度愈大,則組合成的分子軌道的能量愈低,所形成的化學鍵愈牢固,這稱為軌道最大重疊原則。在上述三條原則中,對稱性匹配原則是首要的,它決定原子軌道有無組合成分子軌道的可能性。能量近似原則和軌道最大重疊原則是在符合對稱性匹配原則的前提下,決定分子軌道組合效率的問題。
軌道能量 決定於組成原子軌道的類型和原子軌道間的重疊,例如σg1s和σu1s比σg2s低得多,這是由於原子軌道1s的能量比2s的低得多。同理,因為除
氫原子 外,2s能量顯著低於2p的能量,故σg2s比σg2p能量低。另外,只要核間距不很小,兩個2s軌道或兩個2pz軌道之間的重疊比兩個2py或2px之間的重疊大得多,因此成鍵和反鍵π軌道間的能量差比對應的
σ軌道 的差小。根據這種論述,表2中所列分子軌道次序可預料為:σg1s<σu1s<;σg2s<;σu2s<;σg2p<;πg2p<;πu2p<;σu2p ⑼
上式是一種最粗糙的軌道近似,更好的近似是包含更多的
原子軌道 ,這些原子軌道符合有效成鍵作用的三條件。例如,代替單純的2s以及2pz的
LCAO 所形成的σ型分子軌道應為:
c 1、
c 2、
c 3、
c 4確定後的四個σ軌道比原來的σg2s、σu2s、σg2p和σu2p更接近實際,其中σg2s、σu2s將降低,σg2p及σu2p則升高。加上當核間距變小時,πu2p要降低,導致式⑼中,σg2p與πu2p次序的可能顛倒:πu2p<;σg2p ⑾
⑽ N2分子就屬於這一類型。
有了式⑼與⑽的能級次序,就可按能量最低原理和
泡利原理 來預言同核雙原子分子的基態(表3)。
表中的符號Σ、Π、… 意義與σ、π、… 相同,具有沿核間距方向角動量的含義,標誌完整分子的態,由各個單電子
軌道確定 ;右上角的+、-號指對平分兩核的鏡面反映為對稱或反對稱而言。
多原子分子 的分子軌道 以上基於單電子波動方程近似解的軌道概念和方法,
可自然地向複雜的多原子分子推廣。對雙原子分子,存在沿核間距方向的角動量量子數
m =0,±1,…等來表征軌道或態;但對多原子分子,找不到象H娚那樣簡單而典型的分子,不能精確求解,給問題的討論造成了麻煩。但由於弄清了
量子數 所表征的分子軌道對稱性本質來源於分子自身的對稱性,因而對稱性分析(
群論 )會給出任何分子電子狀態的重要信息,而無需知道分子軌道的具體函式。這方面的進展是巨大的,例如群論在化學中的套用,
能級相關圖 、
分子軌道對稱守恆原理 等的評述。此外,建立在單
電子能級 和軌道近似基礎上的理論計算方法已發展起來,如自由電子分子軌道法、
休克爾分子軌道法 及
推廣的休克爾分子軌道法 等。
表3 如前所述,分子軌道和能級是單電子波動方程的本徵解,即滿足:H ψi=εψi ⑿
式中
H 是單電子
哈密頓算符 ,其中的位能描寫一個電子在固定分子骨架及其餘電子的平均作用。因而,
H 與其餘電子的運動狀態,即軌道有關。前面的討論絲毫未觸及
H 的具體形式,也未對分子軌道作過嚴格定義,所得結論是定性地適用的。為適應理論的定量化發展,已經推導出著名的哈特里-福克方程(見
自洽場分子軌道法 ),對於閉殼層電子體系,式⑿中的
H 採取福克算符的形式:
⒀ 式中h 是純核場中單個電子的哈密頓算符,2J j-K j=J i 和2J j(j ≠i )代表其餘電子的平均靜電勢,K j(j ≠i )稱交換勢能,它來源於泡利不相容原理導致自旋相同電子間的相關作用。J j和K j的表示式均明顯地與分子軌道有關。
採用LCAO方法,分子軌道ψk 按式⑶表示成原子軌道φ l(l =1,2,…,n )的線性組合:
⒁ 代入⑿式,左右兩端乘以
φ 奰並積分,求解歸結為久期方程的本徵值
E k和本徵向量的自洽計算。
哈特里-福克方程 雖然較仔細地考慮了電子間的排斥作用,但由於平均勢場模型仍然使一部分固有的“相關作用”未予考慮,因而理論計算結果仍未達到定量符合實驗值的精度。改進的途徑是考慮組態相互作用,已經出現了多種組態相互作用分子軌道
從頭計算 程式,用於
量子化學 研究。
套用及成就 眾多的物理化學家對分子軌道理論進行了完善,發展出了很多的套用分子軌道理論,解釋物質結構與性質的方法。
HF方法 Hartree-Fock SCF方法是一種從頭算方法,而從頭算方法簡單的說,就是利用一個“正確的”哈密頓算符,除去最基本的常數之外,不再引用任何的實驗數據,以
薛丁格方程 為基礎,僅僅採用非相對論近似,Born-Oppenheimer儘速和單電子近似的基礎上進行的薛丁格方程的求解和分子軌道的計算方法。
半經驗計算方法 半經驗法假定一個近似的
哈密頓算符 ,並利用各種實驗數據,如
電離能 、電子光譜的躍遷能、
鍵能 等數據,將積分的難度進一步簡化,休克爾分子軌道理論(HMO)是這種方法的一個典型事例。
其他方法 還有駐如
量子化學 複合方法(Quantum chem-istry composite methods)、量子蒙特卡洛方法(Quantum MonteCarlo,QM)、組態相互作用(CI)、多組態自洽場方法(MCSCF)、多體微擾理論、耦合簇理(CC)等方法,這些是基於分子軌道理論發展起來的。
 分子軌道理論
分子軌道理論 ⑽
⑽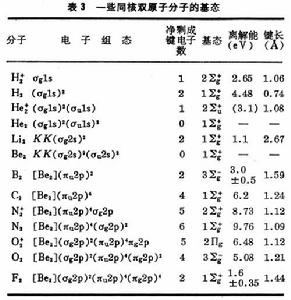 表3
表3 ⒀
⒀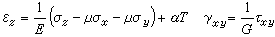 ⒁
⒁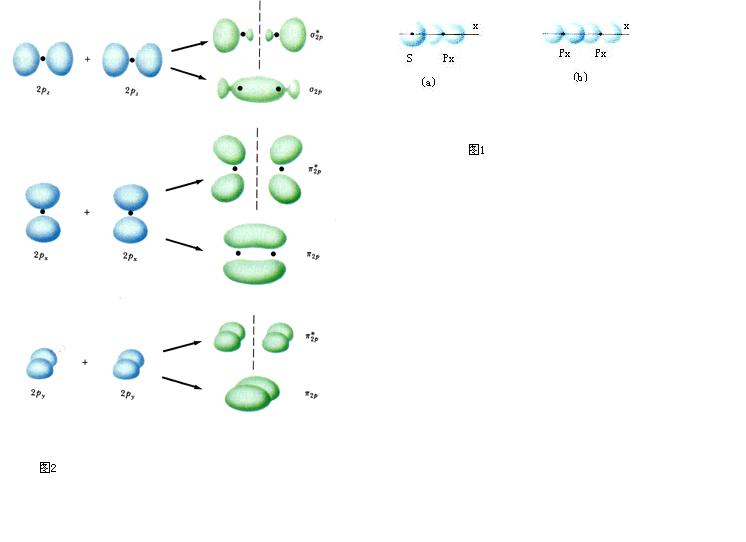
 分子軌道理論
分子軌道理論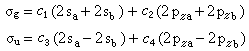 ⑽
⑽ 表3
表3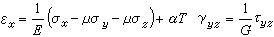 ⒀
⒀ ⒁
⒁