原子核外電子排布規律是指介紹原子核外電子的排布規律,主要有泡利不相容原理、能量最低原理、洪特定則等。
基本介紹
- 中文名:原子核外電子排布規律
- 釋義:介紹原子核外電子的排布規律
- 主要內容:泡利不相容原理、能量最低原理等
- 全充滿:p6或d10 或f14
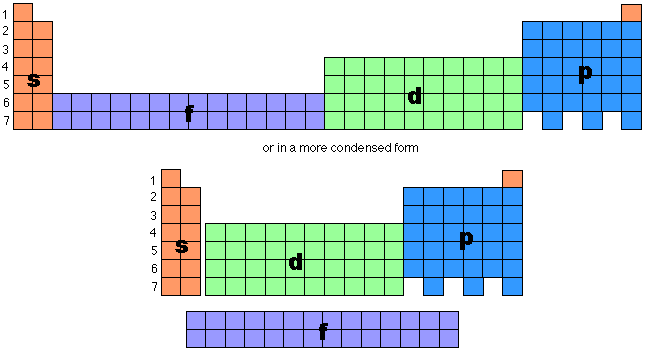
原子核外電子排布規律是指介紹原子核外電子的排布規律,主要有泡利不相容原理、能量最低原理、洪特定則等。
原子核外電子排布規律是指介紹原子核外電子的排布規律,主要有泡利不相容原理、能量最低原理、洪特定則等。...
處於穩定狀態(基態)的原子,核外電子將儘可能地按能量最低原理排布,另外,由於電子不可能都擠在一起,它們還要遵守最低能量原理,泡利不相容原理和洪特規則,一般而言...
處於穩定狀態的原子,核外電子服從一定的分布的原則,在原子核外進行具有一定的規律性的分布。核外電子將儘可能地按能量最低原理排布,另外,由於電子不可能都擠在一...
電子在原子核外排布時,要儘可能使電子的能量最低。一般來說,離核較近的電子具有較低的能量,隨著電子層數的增加,電子的能量越來越大;同一層中,各亞層的能量是...
原子結構示意圖是表示原子核電荷數和電子層排布的圖示形式。小圈和圈內的數字表示原子核和核內質子數,弧線表示電子層,弧線上的數字表示該層的電子數。...
電子在原子核外運動狀態是相當複雜的。一個電子的運動狀態取決於它所處的電子層、電子亞層、軌道的空間伸展方向和自旋狀況。科學實驗還告訴我們,在一個原子裡不...
關於原子內電子排布的一種簡化模型。...... 原子核外電子的排布遵從兩條規律:①泡利不相容原理。原子內不可能有兩個或兩個以上的電子具有完全相同的四個量子數。...
核外粒體是原子核外電子排布的原理之一。處於穩定狀態的原子,核外電子將儘可能地按能量最低原理排布,另外,由於電子不可能都擠在一起,它們還要遵守泡利不相容原理...
電子數,就是電子的數量。電子是一種基本粒子,在化學中,電子數一般是指原子或離子的核外電子的數目。...
氫原子是單電子原子,也就是說,氫原子核外只有一個電子。其餘元素的原子,其電子數都超過一個,例如鈉原子核外有11個電子。在原子核外電子的數目和分布是有一定...
電子是一種微觀粒子,在原子如此小的空間(直徑約10⁻¹⁰m)內運動,核外電子的運動與巨觀物體運動不同,沒有確定的方向和軌跡,只能用電子云描述它在原子核外...
軌道雜化理論是指的原子軌道雜化理論.我們知道原子的核外電子是排布在不同能級的原子軌道上面的,比如S軌道P軌道等等,原子在形成分子時,為了增強成鍵能力(使成鍵...
“系統的能量越低、越穩定”,這是自然界的普遍規律。原子核外電子的排布也遵循 這一規律,多電子原子在基態時,核外電子總是儘可能地先占據能量最低的軌道,然後...
元素周期律(Periodic law),指元素的性質隨著元素的原子序數(即原子核外電子數或核電荷數)的遞增呈周期性變化的規律。周期律的發現是化學系統化過程中的一個重要...
德國人弗里德里希·洪特(F.Hund)根據大量光譜實驗數據總結出一個規律,即電子分布到能量簡併的原子軌道時,優先以自旋相同的方式分別占據不同的軌道,因為這種排布...
所謂原理模型的綜合,是指在抽象化和理想化的條件下,以反映對象的特性和規律的...其中碳原子的核外電子排布不是最低和最穩定狀態的1S2,2S2,2P1x,2Ply的軌道...
在周期表中,元素是以元素的原子序排列,最小的排行最前。表中一橫行稱為一個周期,一列稱為一個族。原子的核外電子排布和性質有明顯的規律性,科學家們是按原子...
