基本介紹
- 中文名:洪特規則
- 外文名:Hund rule
- 別稱:等價軌道規則
- 提出者:洪特(Friedrich Hund)
- 提出時間:1925
- 套用學科:結構化學
- 適用領域範圍:原子核外電子排布
定義
適用範圍
洪特規則前提
詳細信息
洪特規則之一
洪特規則之二
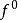

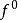

德國人弗里德里希·洪特(F.Hund)根據大量光譜實驗數據總結出一個規律,即電子分布到能量簡併的原子軌道時,優先以自旋相同的方式分別占據不同的軌道,因為這種排布...
洪德定則 (Hund rules) 又名“洪德規則”、“洪特規則”,是原子核外電子排布規律之一。指原子核外電子的排布必先儘可能分占在同一電子亞層的各個軌道上,且...
弗里德里希·洪特(Friedrich Hund),物理學家,德國物理學家,耶魯大學校友,1896年出生,1997年逝世。...
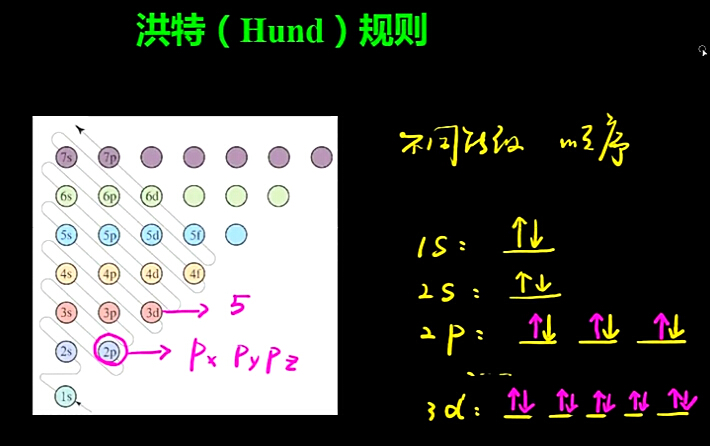
洪特規則是指當電子排布在能量相同的各個軌道時,電子總是儘可能分占不同的原子軌道,且自旋狀態相同,這樣整個原子能量最低。...
洪特規則(英語:Hund's Rule)是原子物理學中對LS耦合電子組態的能級順序的一個規則,於1925年由德國物理學家弗里德里希·洪特(Friedrich Hund)提出。...
處於穩定狀態的原子,核外電子將儘可能地按能量最低原理排布,另外,由於電子不可能都擠在一起,它們還要遵守泡利不相容原理和洪特規則,一般而言,在這三條規則的指導...
洪特規則內容:當電子排布在同一能級的不同軌道時,基態原子中的電子總是優先單獨占據一個軌道,且自旋狀態相同。這個規則由洪特首先提出,稱為洪特規則。...
洪特在總結大量光譜和電離勢數據的基礎上提出洪特規則(Hund's rule):電子在簡併軌道上排布時,將儘可能分占不同的軌道,且自旋平行 [4] 。對於同一個電子亞層...
(3)洪特規則電子層泡利不相容原理 我們已經知道,一個電子的運動狀態要從4個方面來進行描述,即它所處的電子層、電子亞層、電子云的伸展方向以及電子的自旋方向。...
利用能量最低原理、泡利不相容原理和洪特規則,參考基態原子的核外電子在原子軌道上的排布順序,首先應確定原子核外電子的數目,再確定其排布順序,最後根據泡利不相容...
這一規律叫做洪特第一規則;ii)若S和L都相同,則對於半充滿前的組態(如P1,P2或d1,d2,d3,d4)導出的光譜支項而言,J愈小能級愈低;而對於半充滿後的組態(...
(2)洪特規則:當電子排布在同一能級的不同軌道時,總是優先單獨占據一個軌道,而且自旋方向相同。(3)原子軌道表示式每個方框代表一個原子軌道,每個箭頭代表一個電子...
處於穩定狀態(基態)的原子,核外電子將儘可能地按能量最低原理排布,另外,由於電子不可能都擠在一起,它們還要遵守最低能量原理,泡利不相容原理和洪特規則,一般而言...
核外電子將儘可能地按能量最低原理排布,另外,由於電子不可能都擠在一起,它們同時還要遵守泡利不相容原理和洪特規則。一般而言,在這三條規則的指導下,可以推導出...
(6)按能量最低原則,泡利不相容原理和洪特規則在分子軌道中填充電子;(7)求出成鍵軌道和反鍵軌道的電子數,代入公式計算鍵級。鍵級電子空位對假說 電子空位對假說...
4、電子在分子軌道中排布時,遵守“能量最低原理”、“泡利不相容原理”、“洪特規則”; [14] 分子軌道理論能解釋一些價鍵理論無法解釋的現象,比如氧分子的順...
處於穩定狀態的原子,核外電子將儘可能地按能量最低原理排布,另外,由於電子不可能都擠在一起,它們還要遵守泡利不相容原理和洪特規則及其補充規則,一般而言,在這三...
用洪特規則來解釋鑭系元素十3價離子4f亞層的軌道占有情況,發現在釓以上和以下相對應離子的4 f亞層同時達到穩定的半充滿狀態,前者需要得到的電子數與後者需要失去...
