基本介紹
- 中文名:電子雜化
- 對象:共價鍵的本質
- 特點:在共用一對電
- 對應:2個p電子未成對
雜化軌道理論(Hybrid Orbital Theory)是1931年由鮑林(Pauling L)等人在價鍵理論的基礎上提出,它實質上仍屬於現代價鍵理論,但是它在成鍵能力、分子的空間構型等方面...
電子雜化就是化學理論中的一個重要的內容,當原子相互接觸成鍵時,幾個原子的電子互相組合成為新的軌道,以利於成鍵。在同一個原子中,能量相近的不同類型的幾個...
此時,這一個與多個原來處於較低能量的電子亞層的電子所具有的能量增加到和原來能量較高的電子亞層中的電子相同。這樣,這些電子的軌道便混雜在一起,這便是雜化,...
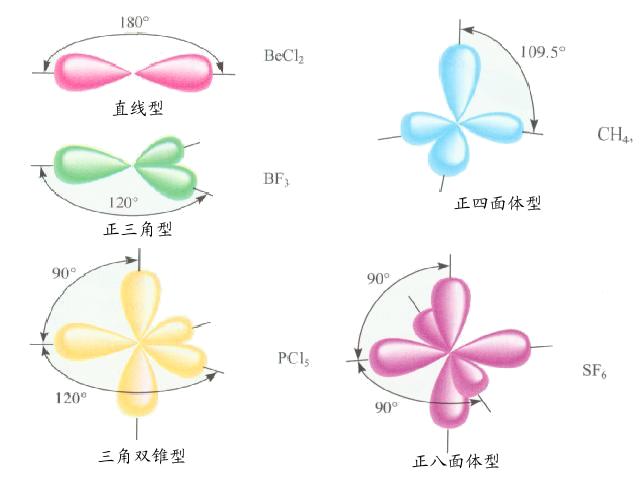
同一原子內由1個ns軌道和3個np軌道參與的雜化稱為sp3雜化,所形成的4個雜化軌道稱sp3雜化軌道。各含有1/4的s成分和3/4的p成分,雜化軌道間的夾角為109°28',...
同一原子內由1個ns 軌道和1個np 軌道參與的雜化稱為sp雜化 ,所形成的兩個雜化軌道稱為sp雜化軌道。每個sp 雜化軌道含有1/2的s成分 和1/2的p成分,雜化軌道...
這一過程稱為電子軌道的雜化。 [1] 雜化軌道理論基本要點 編輯 1、 某原子在成鍵時,在鍵合原子的作用下,同一原子中不同類型能量相近的原子軌道可能改變原有的...
sp2雜化是由同一層的一個s軌道與3個p軌道中的兩個形成,多用於形成兩個單鍵與一個雙鍵,即形成有機物中的烯烴、醛、酮、醯等。Sp2軌道雜化是基於軌道雜化理論...
例如,CH4的形成,基態C原子只有兩個未成 對電子 ,在形成CH4時,在H的影響下,C的1個2S軌道和3個 2p軌道進行sp3雜化,形成4個sp3雜化軌道,每個Sp3雜化軌道中各有...
用化學語言講,雜化軌道理論從電子具有波動性、波可以疊加的觀點出發,認為一個原子和其他原子形成分子時,中心原子所用的電子軌道不是原來純粹的s軌道或p軌道,而是...
雜化軌道可分為等性雜化和不等性雜化兩種。不等性雜化指參加雜化的各原子軌道中所含的未成對電子數不相等,雜化後所生成的雜化軌道的形狀和能量不完全等同,或者說...
在化學反應中,一般是原子的外層電子發生變化。為了簡便起見,化學中常在元素符號周圍用小黑點“.”或小叉“×”來表示元素原子的最外層電子。這種表示的物質的式子...
軌道雜化概念,是由美國化學家鮑林在1931年首先提出的,經過不斷深化和完善,現已成為當今化學鍵理論的重要內容之一。...
表面電子結構引:電子態在空間的位置分布(波函式),電子態的能量分布(態密度)以及能量E與波矢k的關係(能譜)E(k) 總稱為電子結構。表面電子結構則研究固體表面對...
sp3d雜化軌道是由1個ns軌道、3個np軌道和1個nd軌道組合而成的,它的特點是五個雜化軌道在空間呈三角雙錐形,雜化軌道間夾角為90度、120度或180度。...
雜化軌函式是一種冶金的專業術語。...... 教研室本文在原來雜化軌道理論的基礎上,把軌道雜化和核外電子運動的變化結合起來考慮,提出了在等性雜化中,軌道雜化同時電...
價電子數就是價電子的個數。對於主族元素而言,最外層電子就是價電子;稀有氣體沒有價電子數。對於副族元素而言,除了最外層電子外,次外層的d電子也是價電子。...
