基本介紹
- 中文名:分泌蛋白
- 外文名:secreted protein
- 一級學科:生物學
- 二級學科:生物化學,分子生物學
- 主要成分:酶,抗體,激素
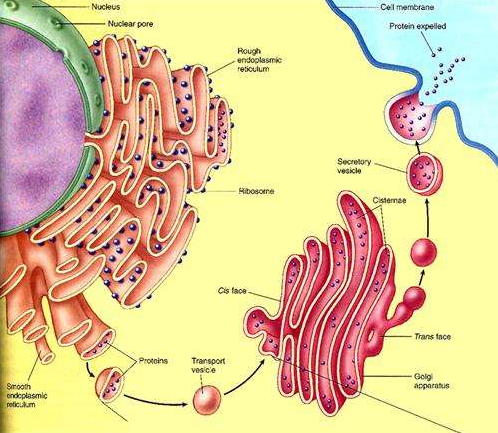
組成生物體的蛋白質大多數是在細胞質中的核糖體上合成的,各種蛋白質合成之後要分別運送到細胞中的不同部位,以保證細胞生命活動的正常進行。有的蛋白質要通過內質網...
分泌性蛋白是指分泌到細胞膜外的蛋白質。分泌性蛋白通過內分泌、旁分泌、自分泌等途徑發揮作用。...
分泌蛋白質是由糙面內質網上核糖體合成,然後送往高爾基體,加工成分泌泡,最終釋放到胞外的蛋白質。...
構成動物結締組織和細胞間質的一類蛋白。主要有膠原、彈性蛋白和蛋白多糖。藉助這3種成分細胞粘合連線形成組織器官。它們不僅有維持細胞形態、機械支持和負重的功能,...
分泌物蛋白質是指由糙面內質網上核糖體合成,然後送往高爾基體,加工成分泌泡,最終釋放到胞外的蛋白質。內質網是真核細胞重要的細胞器,它是由封閉膜系統以及互相溝通...
分泌性蛋白信號假說,即分泌性蛋白N端序列作為信號肽,指導分泌性蛋白到內質網膜上合成在蛋白質合成結束之前信號肽被切除。指導分泌性蛋白在rER上合成的決定因素是蛋白...
胞外蛋白是存在於細胞外的基質里,由細胞合成後分泌出去的蛋白。...... 胞外蛋白是存在於細胞外的基質里,由細胞合成後分泌出去的蛋白。比如蛋白質激素,抗體,消化酶...
TGFBI基因表達的TGFBI蛋白是一種由轉化生長因子β誘導的分泌蛋白,在生物通早期的報導中發現該蛋白與癌症有關聯,很可能成為癌症的一種生物學標記物。...
分泌型表達載體是一種可以表達穿過其合成所在的細胞到其他組織細胞去的蛋白質的載體。利用一段信號肽,可將基因表達產物運送到細胞周質空間,但不是培養基中。利用...
在真核細胞中,分泌型的脂和蛋白質從高爾基體反面的網路結構(trans-Golgi network;TGN;見備註)逐步移向質膜,該過程受到了載體囊泡(carrier vesicle)網路結構的嚴格...
分泌期殺蟲蛋白(secreted insecticidal protein,SIP),即蘇雲金芽孢桿菌(Bacillus thuringiensis, Bt)在其生長分泌期產生的殺蟲活性成分,作為Bt毒蛋白的重要組成部分,...
致病菌為了在宿主體內生存、繁殖和擴散,必須分泌一些蛋白性質的毒力因子;而一些非致病菌為了適應其生活環境,也向外分泌一些蛋白質。革蘭陽性(G+)細菌具有單一胞漿...
分泌小泡是人體細胞內的細胞器高爾基體分泌的一種物質,用來分泌激素的。...... 細胞在合成分泌蛋白時,高爾基體產生的向細胞膜運動的囊泡是分泌小泡。參考資料 1. ...
將定位於內質網、高爾基體、溶酶體的可溶性蛋白和膜蛋白,以及質膜蛋白質和分泌到細胞外的分泌蛋白質進行合成和分揀的細胞途徑。 套用學科 細胞生物學(一級學科),細...
血漿蛋白是指血漿中的蛋白部分,血漿蛋白是多種蛋白質的總稱,血漿蛋白可分為清蛋白、球蛋白和纖維蛋白原等幾種成分。清蛋白在三類蛋白質中分子量最小,但在血漿中...
TTSS全稱是type Ⅲ secretion system(三型分泌系統),是一個由多組分蛋白複合體形成的跨膜通道,它通過分泌蛋白或把這些毒力蛋白直接注入宿主細胞發揮致病作用 ,是...
