信號肽
信號肽的結構
穿過合成所在的細胞到其他組織細胞去的蛋白質, 統稱為分泌性蛋白質( secretory proteins) 。信號肽位於分泌蛋白的N 端, 一般由15~30 個胺基酸組成包括三個區: 一個帶正電的N 末端, 稱為鹼性氨基末端; 一個中間疏水序列, 以中性胺基酸為主, 能夠形成一段α螺旋結構, 它是信號肽的主要功能區;一個較長的帶負電荷的C 末端, 含小分子胺基酸, 是信號序列切割位點, 也稱加工區。當信號肽序列合成後, 被信號識別顆粒( SRP) 所識別, 蛋白質合成暫停或減緩, 信號識別顆粒將核糖體攜帶至內質網上, 蛋白質合成重新開始。在信號肽的引導下, 新合成的蛋白質進入內質網腔, 而信號肽序列則在信號肽酶的作用下被切除。近年來一些研究表明, 許多分泌蛋白的移位信息雖確由一部分疏水肽段所攜帶, 但這一部份肽段可以不在N 端, 如終止轉運序列存在於新生肽鏈的C 端, 也可以不被信號肽酶切除, 如卵清蛋白含有內部信號肽, 它的前體與成熟形式都沒有被信號肽酶切除的過程, 其N-端胺基酸結構在第9 位有帶電基團,疏水結構並不明顯。
信號肽的功能
在布洛貝爾“信號假說”的啟示和有關蛋白質胺基酸序列的比較研究基礎上, 一些新的信號肽先後被發現。這些信號肽負責不同類型蛋白質的新生肽鏈的定位。信號肽的功能, 已不僅決定一個蛋白質是否為分泌蛋白, 而且和蛋白質或其新生肽鏈在細胞內的全方位的定位有關。新生肽鏈或蛋白質中, 一些殘基的化學修飾也是轉譯後加工的一個重要內容。發生修飾的殘基決不是任意的, 也和肽鏈中的胺基酸序列密切相關。從這個意義而言, 這些和殘基修飾有關的肽段, 也可認為是殘基修飾的信號肽。例如, 在肽鏈中連線有N-糖鏈的天冬醯胺殘基(N) , 一定是位於Nx( S/T) 這種特定三肽序列中的天冬醯胺; 一些蛋白質的C 末端附近可以為萜類所修飾, 能接上萜類的半胱氨酸酸殘基, 同樣是具有特定序列的C 末端四肽中的半胱氨酸酸殘基,而且其中某些殘基還決定了所接上的萜類的長度。為此, 可認為在肽鏈中尚存在著與殘基修飾相關的信號肽。
一些肽段的存在與含該肽段肽鏈的降解有關, 這類肽段可以視為肽鏈降解的信號肽。如細胞質中某些帶有KFERQ/RIDKQ 序列的蛋白質易於進入溶酶體,然後在那裡被降解。又如, 細胞質內快速被降解的蛋白質通常含有PEST 四肽序列。
原核分泌表達
大腸桿菌
大腸桿菌是用來表達重組蛋白的首選宿主之一。大腸桿菌遺傳背景清楚,操作簡單,生長周期短,成本低,易於大規模培養,已經用來表達多種酶製劑和藥物製劑,目前市場上有40% 的重組製劑由大腸桿菌表達生產。即便如此,由於大腸桿菌的翻譯後修飾能力較弱,在表達多數結構複雜的蛋白過程中會導致蛋白摺疊錯誤聚集形成無活性的包涵體,嚴重影響蛋白表達量。目前多數蛋白在大腸桿菌胞內表達,需要通過破碎處理獲取目的蛋白,且宿主胞內背景蛋白影響蛋白純化。但利用大腸桿菌分泌系統表達重組蛋白能提高蛋白穩定性及可溶性,保留蛋白N 端真實性,減少宿主代謝負擔,有效簡化蛋白純化過程,節省生產成本。
目前採用的信號肽一般來自大腸桿菌的外膜蛋白( 如外膜蛋白A OmpA 、OmpF、λ噬菌體受體LamB、熱穩定腸毒素STⅡ等) 或周質蛋白( 如鹼性磷酸酶PhoA、麥芽糖結合蛋白MBP、DsbA 等) , 此外金黃色葡萄球菌蛋白A 和胡蘿蔔軟腐歐文氏果膠酶裂解酶( PelB) 的信號肽也常被採用。
常用分泌型載體:
pTA1529:大腸桿菌phoA(鹼性磷酸酶)啟動子和信號肽序列;外源基因插入到信號肽之後;在磷酸鹽飢餓時外源基因表達;由周質信號肽酶切下信號肽
pINIII-ompA:Ipp(脂蛋白基因) + lac(IPTG誘導轉錄)雙啟動子
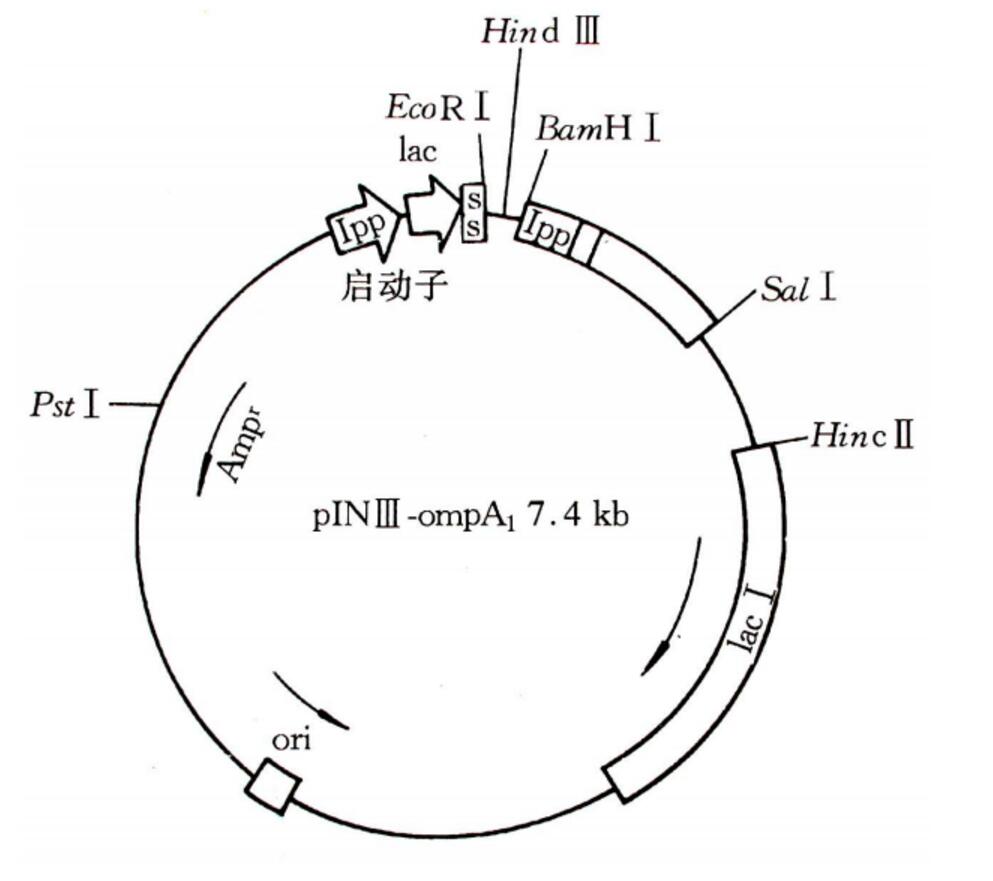 載體圖
載體圖pEZZ18:lac啟動子;金黃色葡萄球菌蛋白A啟動子;蛋白A的信號肽序列;兩個合成的Z功能域
枯草芽孢桿菌
枯草芽孢桿菌是傳統的工業生產菌, 能分泌大量的胞外蛋白, 是研究蛋白質表達和分泌的良好系統,利用它進行工業規模的外源基因表達和分泌, 產生有用的蛋白類產品, 有很重要的經濟價值。枯草芽孢桿菌的信號肽序列長度大多在18 到35 個胺基酸之間,並且不具有一致序列。其特定的典型結構特徵是具有帶正電的NH2 端, 隨後是一段疏水區域(H 區) 和一個極性更強的C 區, C 區帶有一致的酶切識別位點Ala-X-Ala, 酶切發生於羧基端丙氨酸之後。兩個丙氨酸偶爾可以被其他具有短側鏈的胺基酸代替, X 位偏愛具有巨大側鏈的胺基酸。枯草芽孢桿菌信號肽中的疏水區對於蛋白質的分泌有著重要的影響, 適當的疏水性有利於蛋白的分泌, 疏水區過長或過短都不利於蛋白的分泌。有研究表明, 信號肽疏水性能提高促進青黴素G 醯化酶分泌。信號肽的選擇有時能明顯地影響分泌表達水平, 如枯草芽孢桿菌蛋白酶、中性蛋白酶、崖邊桿菌RNA 酶( bamase) 和果聚糖酶等4 種酶的信號肽, 以芽孢桿菌BE1510 為宿主菌, 分別表達重組鏈霉抗生物素蛋白(streptavidin) , 結果中性蛋白酶信號肽的分泌效率最高。
常用分泌型載體:pUB110;pE194;pUCX05-bgaB;pWB980;pHP13;pBE2;pHP13;pHP13-43(p43啟動子);pHT01;pHT43;pAL12.cold-inducible secretion vector,冷誘導分泌型載體;pHT304;pMK3;pMK4;pHCMC04;pHCMC05;pMA5;pHY300PLK;pMUTIN4基因組整合型載體;pBesT502帶有枯草桿菌強啟動子PrepU等。
真核分泌表達
真核生物不但有細胞核、細胞質和細胞膜, 而且還有許多膜性結構的細胞器, 像原核細胞一樣, 真核細胞合成的蛋白質N 端也有信號肽, 其也能形成兩個α螺旋的髮夾結構, 這個結構可插入到內質網膜,正在合成的多肽鏈帶和內質網內腔內。通常,真核表達系統比原核表達系統更能有效的表達有功能的真核蛋白,主要原因總結起來如下: 首先,原核生物缺乏真核蛋白分泌機制,使它們很難正確的表達,摺疊,裝配,穩定真核蛋白;其次,真核細胞與原核細胞的不同的脂質雙分子層組成,以及真核細胞中更精細的轉位子複合體(膜蛋白轉位和插入的位點);第三,真核細胞中蛋白質翻譯和摺疊的速率相對較慢,這避免了新合成的蛋白質大量堆積,而大量堆積的蛋白質不利於細胞的生長代謝,有時候對宿主甚至是致命的;最後,原核生物缺乏翻譯後修飾的機制,包括糖基化,磷酸化和乙醯化等,而這些機制對表達有功能活性的真核蛋白卻是至關重要的。目前,主要有三個真核表達系統廣泛套用於真核膜蛋白的重組表達:酵母、昆蟲細胞及哺乳動物細胞,並得到了較深入的探討和研究。
酵母表達系統
一般說來,酵母作為表達系統在真核蛋白的表達上具有一些明顯的優勢。和細菌一樣,酵母遺傳操作簡單、可以在短期內大批量培養,價格低廉;同時,作為真核生物,表達的蛋白質在酵母細胞里的翻譯後修飾機制與哺乳動物細胞相似。主要有兩個酵母系統廣泛用於蛋白質表達,它們分別是釀酒酵母表達系統和畢赤酵母表達系統。
酵母表達系統中研究較清楚、套用最廣的是Pichia.Pastoris。目前酵母表達系統中常使用的信號肽包括某些外源蛋白自身的天然信號肽、α-因子信號肽( α-MF) 、蔗糖酶基因SUC2 信號肽序列、酸性磷酸酶基因PHO1 的信號肽序列、間質金屬蛋白酶(MMP) /間質金屬蛋白酶組織抑制劑信號肽序列。其中α-因子信號肽( α-MF) 使用最廣。α-因子信號序列由87 個胺基酸組成, 是來自S.cerevsiae 的α性成熟因子前導序列, 並且已將這段序列編碼的信號肽插入到幾個P.Pastoris 的表達載體中( Invitrogen) , 用於外源基因的分泌表達, 如pGAPZα-A、B、C 與pMETα-A、B、C 等。在構建α-因子信號肽融合基因時, 需保留KeX2 蛋白酶切位點附近的谷氨酸- 丙氨酸(Glu-Ala) 間隔區, Glu-Ala 的存在會避免錯誤切割的發生。
常用分泌型載體:pPIC9,pPIC9K,pHIL-S1,pPICZα,pYAM75P 等。
昆蟲表達系統
昆蟲桿狀病毒表達載體系統自1983 年建立以來, 已經發展成為較完善的真核表達系統, 成功的表達了多種外源基因。但信號肽在昆蟲表達系統中的套用還很有限。
目前在昆蟲表達載體中對信號肽在基因工程套用上的研究結果主要有: 1) 信號肽能被信號肽酶正確識別和切割, 能促進產物的分泌, 如利用α-干擾素信號肽和IL-3 信號肽構建的昆蟲桿狀病毒分泌載體,含蜂蜜毒肽的信號肽載體能提高木瓜蛋白酶的分泌效率5~9 倍。2) 信號肽能使產物分泌至細胞外, 但在不正確位點切割, 如利用MAG 信號肽表達的睫狀體神經營養因子(CNTF)。3) 信號肽不能引導分泌表達, 如澱粉酶的信號肽不能引導木瓜蛋白酶的分泌表達。4) 信號肽不能被切除, 如用gp67 信號肽引導慈姑蛋白酶抑制劑(API) 基因在昆蟲表達載體中表達雖獲得了高效表達, 且表達產物的90%以上能分泌到細胞外, 但信號肽在表達過程中都沒有被切除。
哺乳動物細胞表達系統
通常認為,當表達真核蛋白時,哺乳動物細胞可以為表達和維持其結構和功能完整性提供最自然的細胞環境。傳統上,哺乳動物表達系統依靠的是穩定轉化株的分離或者病毒載體的使用。其中使用最廣泛的病毒載體是塞姆利基森林病毒(Semliki Forest Virus, SFV)。然而,細胞大批量培養及轉染技術的困難和昂貴的價格限制了其在表達中的套用。近幾年,隨著無血清培養基及相對廉價轉染試劑的發展和使用,哺乳動物細胞的大規模瞬時轉染(large-scale transient transfection, LSTT)技術已經逐步被套用。歐洲結構蛋白質組學會(Structural Proteomics IN Europe, SPINE)研究了使用 LSTT法的各種蛋白質的表達特徵,指出和其他表達系統相比,分泌型蛋白的表達最為完整有效,而胞質蛋白和膜蛋白則使用桿狀病毒載體有更好的表達。在未來幾年,在哺乳動物細胞中蛋白質表達很可能是表達體系研究中最重要的領域之一。
 載體圖
載體圖
 載體圖
載體圖