理論簡介
求解分子軌道Ψ很困難,一般採用近似解法,其中最常用的方法是把分子軌道看成是所屬原子軌道的線性組合,這種近似的處理方法叫做原子軌道線性組合法,用英文的縮寫字母
LCAO表示(linearcombinationofatomicorbitals),簡稱為LCAO法。波函式的近似解需要複雜的數學運算,應在結構化學中討論,這裡只介紹求解結構所得的直觀圖形,以期達到了解共價鍵形成的過程。
分子軌道理論認為化學鍵是原子軌道重疊產生的。有幾個原子軌道就能線性組合成幾個分子軌道。那么,當兩個原子軌道重疊時,可以形成兩個分子軌道Ψ=Ψ±Ψ。Ψ和Ψ分別代表兩個原子軌道。其中一個分子軌道是由兩個原子軌道的波函式相加而成,叫
成鍵軌道(bonding orbital)。
成鍵軌道
在分子軌道Ψ1中,兩個原子軌道的波函式的符號相同,即波相相同,這兩個波相互作用的結果,使兩個原子核之間有相當高的電子機率,顯然抵消了原子核相互排斥的作用,原子軌道重疊達到最大程度,把兩個原子結合起來,因此Ψ1被稱為成鍵軌道。
反鍵軌道
另一個分子軌道由兩個原子軌道的波函式相減而成,叫
反鍵軌道(antibondingorbital),Ψ=Ψ-Ψ。
在分子軌道Ψ中,兩個原子軌道的波函式的符號相反,即波相不同,這兩個波相互作用的結果,使兩個原子核間的波函式值減小或抵消,在原子核之間的區域,電子出現的機率為零,也就是說,在原子核之間沒有電子來結合,兩個原子軌道不重疊,故不能成鍵,因此Ψ被稱為反鍵軌道。如圖2-12所示。
成鍵軌道和反鍵軌道的電子云密度可通過下列式子計算而得:
Ψ=(Ψ+Ψ)=Ψ+Ψ+2Ψ·Ψ
Ψ=(Ψ-Ψ)=Ψ+Ψ-2Ψ·Ψ
由上式可知,在成鍵軌道Ψ中,兩核間電子云密度很大,其能量較原子軌道能量低,有助於成鍵。而在反鍵軌道Ψ中,兩核間電子云密度為零,其能量較原子軌道能量高,不能成鍵。
成鍵軌道和反鍵軌道的電子云密度分布也可用等密度線表示。
圖中各曲線是當軌道上只填入一個電子時的電子云密度曲線,曲線上的數字即Ψ數值,由外往裡,數字逐漸增大,電子云密度也逐漸增大,反鍵軌道在中間有一結面,結面兩側波函式符號相反,在結面上電子云密度為零。所以成鍵軌道的電子云在兩個核之間較多,對核有吸引力,使兩個核接近而降低了能量,而反鍵軌道的電子云在兩個核之間很少,主要在兩核的外側對核吸引而使核遠離,同時兩個核又有排斥作用,因而能量增加。可見,原子間共價鍵的形成是由於電子轉入成鍵的分子軌道的結果,例如氫分子中兩個ls電子,占據成鍵軌道且自旋反平行,而反鍵軌道是空的。
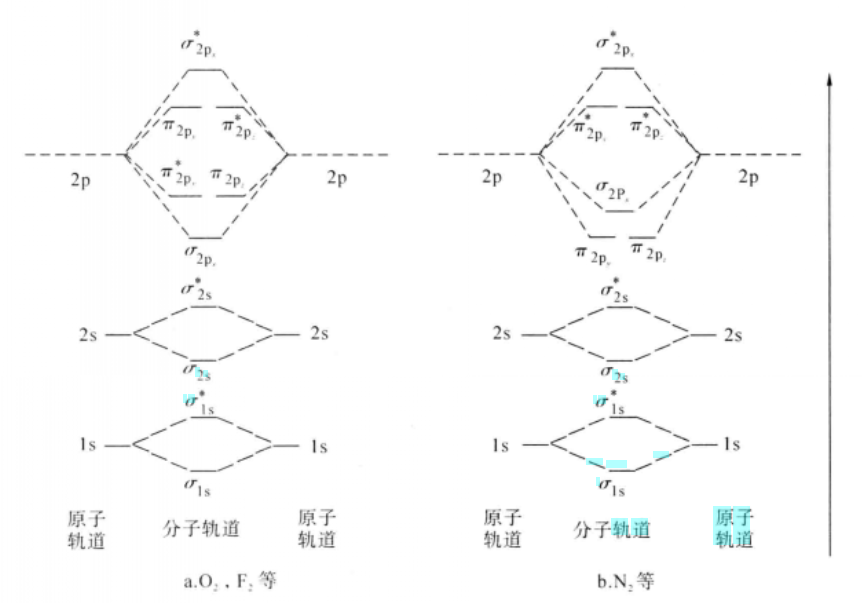
兩個s軌道組合成的成鍵軌道用σ表示,反鍵軌道用σ表示。由兩個p軌道組合成分子軌道時,可以有兩種方式:一種是“頭對頭”的組合;另一種是“肩並肩”的組合。它們都分別形成一個成鍵軌道和一個反鍵軌道。由“頭對頭”組成的分子軌道,仍稱σ分子軌道,由“肩並肩”形成的分子軌道則稱π分子軌道,它的反鍵軌道用π表示。
軌道形成三原則
分子軌道線性組合需要遵循以下三條基本原則:
對稱性一致原則
對稱性一致原則是指對核間連線呈相同對稱性的軌道,才有可能進行線性組合。除s-s,p-p組合之外,還有s-p.沿x方向的組合,兩者的對稱性一致,可以組成σ分子軌道。另外py-dxy沿x方向,對稱性一致,也可以組合成有效的π分子軌道。如下圖::
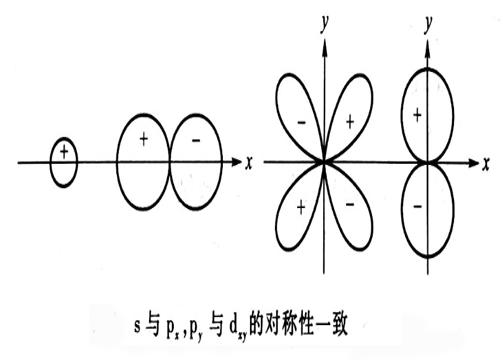 對稱性一致
對稱性一致能量相近原則
能量相近原則是指軌道能量相近時彼此間才有可能進行線性組合。根據元素
第一電離能的值估算,可得到以下原子軌道近似的能量數據:
 第一電離能
第一電離能H的1s,O的2p,Cl的3p,這3條軌道能量相近,彼此間均可組合,形成分子軌道。但Na的3s比上述3條軌道的能量高許多,不能與之組合。實際上Na與H,Cl,O一般不形成共價鍵,只以離子鍵相結合。
最大重疊原則
最大重疊原理是指在對稱性一致、能量相近的基礎上,原子軌道重疊的程度越大,越容易形成分子軌道即生成成鍵軌道,或者說形成的共價鍵越強。
科研意義
價鍵法和分子軌道法都是以量子力學的波動方程為理論依據,它們用不同的方法提示共價鍵的本質,可以說是殊途同歸。分子軌道理論比較全面地反映了分子中電子的各種運動狀態,運用該理論可以說明共價鍵的形成.也可以解釋分子或離子中單鍵和三電子鍵的形成,但在解釋分子的幾何構型時不夠直觀。分子軌道理論和價鍵理論都以量子力學原理為基礎,在處理化學問題時各有優勢:它們可以互為補充,相輔相成,為人們解釋化學結構和某些化學現象提供了可靠的理論依據。
 對稱性一致
對稱性一致 第一電離能
第一電離能