基本介紹
含義,簡介,流行病學,侵犯部位,特徵,影像學,細胞學,巨檢部位,腫瘤擴散,病理學,電鏡,免疫組化,鑑別診斷,遺傳學,分子遺傳,基因沉默,基因表達,預測因素,臨床標準,病理標準,規範治療,
含義
簡介
流行病學
90%以上的肺鱗狀細胞癌發生於抽吸香菸的吸菸者。砷也與鱗狀細胞癌的發生關係密切。
侵犯部位
大部分肺鱗狀細胞癌起源於中心性主支氣管、葉支氣管或段支氣管。
特徵
影像學
放射X線檢查:中央型SCC可發生肺葉或整個肺萎陷,伴有縱隔向患側移位。中心性段或段以下支氣管腫瘤可擴散至局域淋巴結,表現為肺門、肺門周圍或縱隔陰影,伴或不伴有局部肺萎陷。外周性腫瘤表現為孤立的肺部結節(<3cm)或腫塊(>3cm)。鱗狀細胞癌是形成空洞最常見的肺癌類型,在胸片上可見不規則的厚壁空洞。當腫瘤位於肺上溝時,稱之為Pancoast腫瘤,常伴有胸後壁肋骨破壞,可導致Horner綜合徵。一些小氣管或支氣管內腫瘤的胸部X線可表現正常。肺門陰影、肺不張或周圍腫塊可伴有胸腔積液、縱隔擴大或橫隔一側抬高。
PET掃描:是鑑別轉移發生的可選擇方法(除需MRI檢測的腦轉移外)。骨轉移典型呈溶骨性表現。
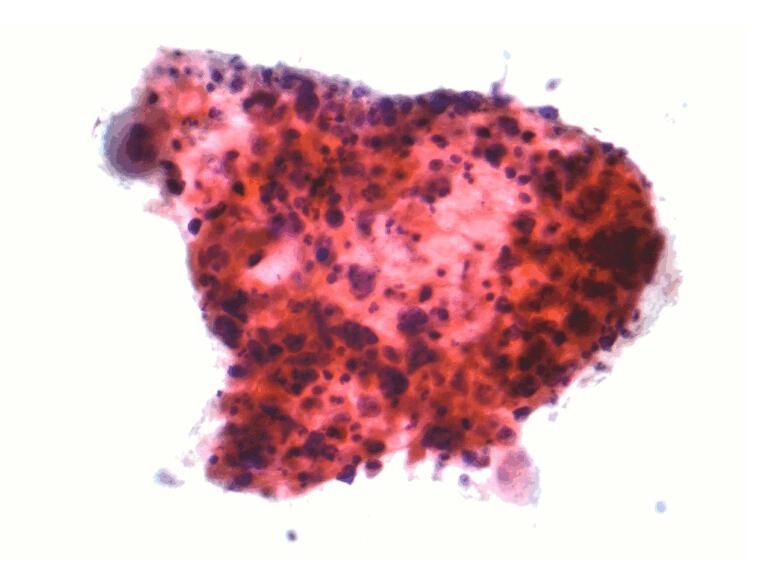
細胞學
在壞死和細胞碎屑的背景中可見到大的腫瘤細胞,伴有不規則的深染的核,位於中央,有一個或多個小核仁,胞漿豐富。腫瘤細胞常散在分布,可呈奇特的形狀如梭形和蝌蚪形,也可表現粘附性聚集,通常呈扁平片狀伴有拉長的或梭形核。在分化良好的鱗狀細胞癌中角化的胞漿通過Romanowsky染色呈現刺槐毒素的(robin’s)蛋藍色,而通過Papanicolaou染色可呈橙黃色或黃色。在脫落細胞標本中以表層腫瘤細胞為主,表現為單個散在分布,具有明顯角化的胞漿和緻密深染的核。相反,在刷取的標本中細胞多取自較深層組織,可見更多的細胞表現為粘附性聚集。
巨檢部位
腫瘤外觀根據纖維化程度不同常呈白色或灰色,質地較硬,伴有局部碳樣色素沉著,在病變中央呈星狀倒行至四周。腫瘤可表現巨大並伴有空洞形成。中央型腫瘤可形成腔內息肉狀腫塊和/或透過支氣管壁向周圍組織浸潤,也可阻塞支氣管腔導致支氣管分泌物瀦積、肺不張、支氣管擴張、阻塞性脂樣肺炎和感染性支氣管肺炎。少數病例可來源於外周小氣道。但研究結果有所改變因為一項研究報導53%的鱗狀細胞癌可發生於周圍肺部。
腫瘤擴散
中央型鱗狀細胞癌以兩大擴散方式為特徵:上皮內擴散(原位)伴或不伴皮下侵犯和支氣管內息肉狀生長。廣泛的上皮內擴散常見於主要的支氣管。支氣管腺體或導管上皮常被侵及。關於早期浸潤性鱗狀細胞癌的兩種生長方式已有描述:一種是沿著支氣管一側黏膜生長替代表層上皮,伴黏膜下微浸潤和腺體導管侵犯(蔓延型);另一種表現為小的息肉樣黏膜病變,伴向深層浸潤(穿透型)。肺門縱隔組織包括淋巴結的直接侵犯可在進展期病例中見到。
周圍型鱗狀細胞癌以形成實性結節為特徵,常伴有支氣管內結節性生長、上皮內擴散或兩者兼有。在進展期病例中周圍型鱗狀細胞癌可直接透過胸膜侵犯胸壁或橫隔。
分期通常根據TNM方法進行。一般來說,鱗狀細胞癌傾向於表現為通過直接擴散侵犯局部鄰近組織。與腺癌或其它原發性肺癌組織類型相比,鱗狀細胞癌較少發生遠處器官轉移。直徑<2cm的周圍型腫瘤較少發生局部淋巴結轉移。分化差的腫瘤可在病變早期轉移至腦、肝臟、腎上腺、下消化道和淋巴結。手術切除後局部復發在鱗狀細胞癌中比其它類型的肺癌更常見。
病理學
鱗狀細胞癌可表現角化、角化珠形成和/或細胞間橋等特徵。這些特徵隨分化程度而表現不同。在分化良好的腫瘤中該特徵表現明顯,而在分化差的腫瘤中僅局部可見。
乳頭狀型SCC。一些位於近端支氣管的腫瘤可表現向外生長和支氣管內生長。有時僅可見非常局限的上皮內擴散不伴有浸潤,但是大多數病例中存在浸潤形成。
透明細胞型SCC。主要或幾乎全部由伴透明胞漿的細胞組成。該型需要與大細胞癌、伴廣泛透明細胞改變的肺腺癌和腎臟轉移性透明細胞癌相區分。
小細胞型SCC是一種分化差的鱗狀細胞癌,小腫瘤細胞保留有非小細胞癌的形態特徵,並表現局部鱗狀分化。該型必須與混合有鱗狀細胞癌及真正的小細胞癌的複合性小細胞癌相鑑別。小細胞型SCC缺乏小細胞癌具有的細胞核特徵,即具有粗糙或泡狀染色質、更明顯的核仁、更豐富的胞漿和更清楚的細胞邊界。局部可見到細胞間橋或角化。
基底樣型可表現明顯的呈周圍柵欄狀排列的核。伴廣泛的基底樣生長模式但缺乏鱗狀分化特徵的分化差的肺癌可認為是基底樣型的大細胞癌。
有報導描述了一種表現肺泡腔填充型的周圍型SCC:腫瘤細胞充滿了肺泡腔但不伴有肺泡結構的破壞,這與可導致肺泡結構和肺組織結構破壞的擴展型SCC正好相反。該型僅約占周圍型SCC的5%。罕見的無角化鱗狀細胞癌可類似於移行細胞癌。
電鏡
免疫組化
絕大多數的鱗狀細胞癌可表現高分子量角蛋白(34βE12)、細胞角蛋白5/6和癌胚抗原(CEA)高表達。許多病例可表達低分子量角蛋白(35βH11)和極少數表達甲狀腺轉錄因子-1(TTF-1)或細胞角蛋白7(CK7)。
鑑別診斷
與大細胞癌相區分的依據是鱗狀分化是否存在。局部可存在胞內粘蛋白。即使侵襲性生長未得到確定,如果具有明顯的細胞不典型也可確定乳頭狀型SCC的診斷。小的活檢標本表現分化良好的乳頭狀鱗狀上皮時診斷應謹慎,因為乳頭狀鱗癌與乳頭狀瘤的區分是困難的。肺的疣狀癌非常罕見,包括在乳頭狀鱗癌之中。前縱隔組織廣泛侵襲可導致與胸腺鱗狀細胞癌鑑別診斷困難,需要與手術和放射學檢查結果相結合。在肺間質中,鱗狀細胞癌可被肺泡細胞包繞,有時可被誤診為腺鱗癌。在瀰漫性肺泡破壞(DAD)中存在鱗狀化生伴細胞不典型應考慮鱗狀細胞癌的可能。DAD的一般特徵表現如透明膜、瀰漫性肺泡隔結締組織增生伴肺泡細胞增生和細支氣管中心性鱗化等有利於認為DAD是一種化生的病變過程。
遺傳學
細胞遺傳學和CGH
研究發現肺鱗狀細胞癌和腺癌之間存在一些差異。肺鱗狀細胞癌是一種近二倍體或是超二倍體—非整倍體的腫瘤伴有平均染色體數目(在三倍體範圍內)。研究認為通過DNA測量檢測非整倍性可預測差的預後。細胞遺傳學和CGH證實了伴有3q端粒擴增的許多遺傳學改變是鱗癌表型的最常見特徵。3q24-qter獲得可存在於大多數鱗狀細胞癌和少數腺癌中。擴增基因尚未明確,其中一個代表基因是P1K3CA,編碼磷脂醯膽鹼-3激酶的催化亞單位,它是許多細胞信號傳導通路的一個基本組分。3號染色體短臂缺失也較常見。其它再發的改變包括染色體4q、5q、8p、9p、10q、11p、13q、17p、18q和21q的缺失伴染色體5p、8q、11q13和12p重複。在病變進展過程中染色體失衡的數目累積增加。小的中間缺失具有基因片段大小增加的趨勢,導致與小細胞癌類似的缺失模式。所有重複的染色體臂可凝集形成略小的擴增子。一些特異的改變特別是3p12-p14、4p15-p16、8p22-p23、10q、21q的缺失和1q21-q25、8q11-q25重複與轉移表現型有關。
分子遺傳
鱗狀細胞癌常表現獨特的分子遺傳學特徵。ErbB(EGFR,HER2/neu,KRAS)通路異常常見於非小細胞癌中但不存在於SCLC中。平均84%的鱗狀細胞癌呈EGFR陽性。可檢測出表皮生長因子受體蛋白表達的肺癌以鱗癌多見。HER2/neu表達在腺癌中較常見而在鱗癌中少見。KRAS基因活化突變在腺癌中常見(~30%),而在鱗狀細胞癌中罕見。
正常P53基因功能常因為點突變而導致破壞,並在所有類型的肺癌中常見。較多發生於SCLC的突變也可發生於大部分的NSCLC腫瘤包括鱗狀細胞癌。
RB基因通路破壞在肺癌中普遍存在。RB基因突變是SCLC中常見的通路破壞機制,但較少見於NSCLC。NSCLC中的破壞機制主要是通過上游通路,特別是由胚胎學或遺傳學機制(純合性缺失、突變、甲基化)導致的P16Ink4失活,可通過免疫組化證實。而cyclinD1和E可呈過表達。
大多數鱗狀細胞癌證實存在大的3p等位基因片段丟失,而大部分腺癌和癌前/侵襲前病變表現為較小的3p等位基因片段丟失。FHIT是研究較為清楚的基因之一,位於染色體3p14.2,常表現缺失和啟動子區域甲基化。另一定位於3p21.3的RASSF1A基因更常在SCLC中表現失活,研究並未證實NSCLC類型之間存在甲基化發生頻率的差異。
基因沉默
胚胎性基因沉默的主要機制是甲基化,但組蛋白去乙醯化也有重要的協同作用。已經知道或者是懷疑大多數沉默的基因是抑癌基因。甲基化圖譜隨腫瘤類型而不同,且APC、CDH13和RAR-β的甲基化頻率在腺癌中明顯高於鱗狀細胞癌。
基因表達
肺鱗狀細胞癌以高水平表達角蛋白基因和表現角化為特徵。已採用寡核苷酸和cDNA微陣列雜交技術和基因表達序列分析或SAGE方法對肺鱗狀細胞癌的標記物進行了分析。研究結果經比較發現存在明顯的重疊。角蛋白5、6、13、14、16、17和19基因在肺鱗狀細胞癌的基因表達標記物中占主要地位。在多項研究中報導的其它作為鱗狀細胞癌標記物的基因包括膠原VIIα1、galectin7、運動失調性毛細血管擴張症D組相關蛋白、S-100鈣結合蛋白A2和大天皰瘡樣抗原1。另外,肺鱗狀細胞癌以P53相關基因P63過表達為特徵。根據採用SAGE方法創建的基因表達圖譜已完成與之相結合的包括每一條染色體臂的轉錄圖譜。該圖譜顯示了在鱗狀細胞癌中伴有明顯改變的基因表達方式的已知染色體區域和一個新的位點。這些分子改變的確認可提供肺癌潛在的標記物。
預測因素
根據分期,鱗狀細胞癌的生存率明顯高於腺癌。大約80%的手術切除I期(T1N0M0)鱗狀細胞癌患者在診斷後5年仍生存,而與之相比,約70%的同樣分期的腺癌患者生存。2期鱗狀細胞癌和腺癌患者的生存率之間存在同樣的差異。可指導預後的重要組織學因素難以確定,但是與無壞死存在的腫瘤相比,表現廣泛壞死的腫瘤被認為與預後差相關。
臨床標準
雖然臨床分期通常是由病變範圍決定的,cTNM分期是一項主要的預後因素。手術患者與其餘的患者(70%)之間具有截然不同的生存差異。非手術病例表現體重下降、行為表現差和轉移相關症狀提示預後差。在切除腫瘤的患者中年齡大是手術後死亡率上升的原因之一。女性性別是肺癌總生存率的有利因素,但是對於腺癌患者來說其臨床意義比鱗癌患者要明顯。當從影響預後的社會-經濟因素中分出時,種族並不是一項預後相關因素。許多生物學檢測指標已經公布,如乳酸脫氫酶(LDH)或血清腫瘤標誌物,但是它們和/或體重下降在大多數病例中並不是cTNM分期的獨立因素。
病理標準
診斷時的疾病分期和行為表現對於原發性鱗狀細胞癌來說仍然是作用最強的預後指標。但是組織學分型可提供獨立的預測預後的信息。例如,分化良好的鱗狀細胞癌傾向於在胸部局部擴散,直接侵犯鄰近的縱隔組織;而分化差的鱗狀細胞癌傾向於早期和遠處轉移。肺泡腔填充型周圍鱗狀細胞癌的預後較好。
規範治療
手術、放療、化療,這些都與5年生存率有關,單以病理類型而言,據院腫瘤1726切除病例發現5年生存率為46%。治療情況也要根據手術病理來決定,術後放療只適用於手術未能全部切除腫瘤及轉移灶者,對有淋巴結轉移時術後放療可提高生存率。化療,無論在SCLC或是NCLC,綜合治療中均成為肺癌治療不可或缺的手段之一,方案根據具體病情來定。