SYBR Green I是一種結合於所有dsDNA雙螺旋小溝區域的具有綠色激發波長的染料。在游離狀態下,SYBR Green I發出微弱的螢光,但一旦與雙鏈DNA結合後,螢光大大增強。因此,SYBR Green I的螢光信號強度與雙鏈DNA的數量相關,可以根據螢光信號檢測出PCR體系存在的雙鏈DNA數量。SYBR Green I 的最大吸收波長約為497nm,發射波長最大約為520nm。
基本介紹
- 中文名:SYBR Green I
- 特點:具有綠色激發波長
- 性質:染料
- 操作:無須脫色或沖洗
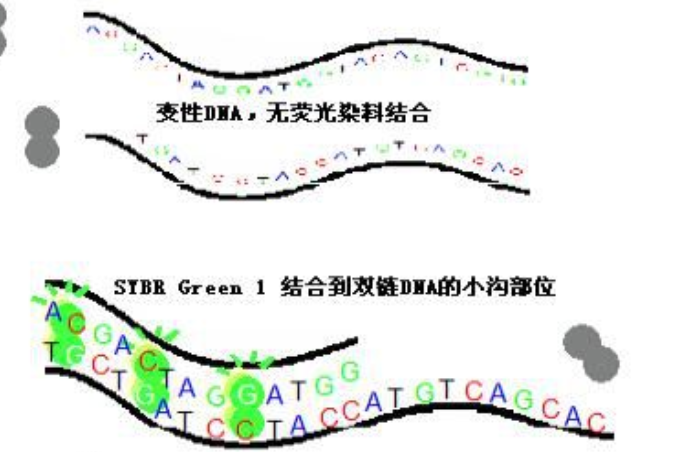
SYBR Green I是一種結合於所有dsDNA雙螺旋小溝區域的具有綠色激發波長的染料。在游離狀態下,SYBR Green I發出微弱的螢光,但一旦與雙鏈DNA結合後,螢光大大增強。因此,SYBR Green I的螢光信號強度與雙鏈DNA的數量相關,可以根據螢光信號檢測出PCR體系存在的雙鏈DNA數量。SYBR Green I 的最大吸收波長約為497nm,發射波長最大約為520nm。
SYBR Green I是一種結合於所有dsDNA雙螺旋小溝區域的具有綠色激發波長的染料。在游離狀態下,SYBR Green I發出微弱的螢光,但一旦與雙鏈DNA結合後,螢光大大增強。...
。 SYBR Green I 和 SYBR Gold 也被廠家宣傳為最靈敏的凝膠染色試劑。但 SYBR Green I 尤其是 SYBR Gold 在常用的微鹼性電泳緩衝溶液或預製凝膠中會快速降解,...
其定量的基本原理是在 PCR 反應體系中加入非特異性的螢光染料(如: SYBR GREEN I )或特異性的螢光探針(如: Taqman 探針),實時檢測螢光量的變化,獲得不同樣品...
Detection of PCV2 DNA by SYBR Green I-based quantitative PCR, Journal of Zhejiang University Science B, 2007, 8(3):162-169....
39. SYBR Green I實時螢光定量聚合酶鏈反應檢測DNA甲基化方法的建立。中華檢驗醫學雜誌,200740. 5-氮-2-脫氧胞苷對Daudi淋巴瘤細胞株SHP-1基因甲基化及生長狀態...
做Real Time時,用於SYBR Green I法時的一對引物與一般PCR的引物,在引物設計上所要求的參數是不同的。引物設計的要求:●避免重複鹼基,尤其是G....
根據引入螢光標記的類型,常用的實時螢光定量PCR有如下幾種:SYBR Green法、水解探針法( TaqMan法)、雜交探針法以及分子信標法等。1、SYBR Green法...
優惠包乾價:120元/樣/基因(SYBRgreenI法,相對定量) (含RNA提取,反轉錄,引物合成費用,上機測試費用(3個重複);一個內參免費(內參3個重複) 技術原理 將標記...
包括RNA提取、反轉錄和擴增,採用SYBR Green I法和TaqMan探針法兩種方式,一般採用2法進行計算。每個樣本重複三次,一般情況我公司提供內參基因引物。2.絕對定量...
實時螢光定量常用的螢光化學分類有SYBR Green I法和Tag Man探針法。①SYBR Green I法:SYBR Green I是一種具有綠色激發波長的染料,最大吸收波長約為 497 nm,...
7 實時定量PCR 按以下反應體系進行: 2x RealqPCR MasterMix(Modified DNA polymerase、SYBR Green I、Optimized PCR buffer、5mM MgCI2、dNTP mix including dUTP)...
● 靈敏度高:適用於各種大小片段的電泳染色,對核酸遷移的影響小於SYBR Green I。● 穩定性高: 適用於使用微波或其它加熱方法製備瓊脂糖凝膠;室溫下在酸或鹼緩衝...
Y.(2013).Quantitative detection ofProteusspecies by real-time polymerase chain reaction using SYBR Green I.Annals of Microbiology, 63(3), 1205-1208. Lin...
Xiaobo Xing*.Detection of microRNA in clinical tumor samples by isothermal enzyme-free amplification and label-free grapheme oxide-based SYBR Green I ...
Photocatalytic oxidation of TMB with the double stranded DNA-SYBR Green I complex for label-free and universal colorimetric bioassay. Chemical Communication. ...
20. 榮小軍,廖梅傑,張正,王印庚,劉智超,李彬,王嵐,陳貴平.遲緩愛德華氏菌SYBR GreenI實時螢光定量PCR檢測方法的建立及其套用,水產學報,2013,37(12):1829-1838...
W., 2007. Development of a SYBR green I Real-time PCR for quantitative detection of Vibro alginolyticus in seawater and sea food. Journal of Applied ...
螢光定量PCR最常用的方法是DNA結合染料SYBR GreenⅠ的非特異性方法和Taqman水解探針的特異性方法,在這裡主要介紹這2種方法,其它方法請參考其它螢光定量PCR資料。...
包括RNA提取、反轉錄和擴增,採用SYBR Green I法和TaqMan探針法兩種方式,一般採用2- ΔΔ Ct 法進行計算。每個樣本重複三次,一般情況我公司提供內參基因引物。2....
試劑SYBR Green I,FAM,Tex Red,FITC等螢光染料,開放式PCR試劑反應體系 10-100μL建議質控 四個陽性標準品、陰性對照指標 螢光激發波長 470nm...
