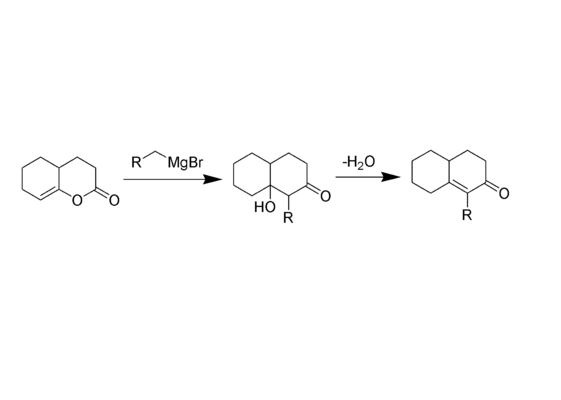
烯醇內酯與格式試劑反應生成環狀α-取代-α,β-不飽和酮。是對Robinson環化反應的另一種選擇。
Robinson反應:含活潑亞甲基的環酮與a,b-不飽和羰基化合物在鹼存在下反應,形成一個二並六元環的環系。
基本介紹
- 中文名:Fujinmoto-Belleau反應
- 底物:烯醇內酯與格式試劑
- 產物:環狀α-取代-α,β-不飽和酮
- 相關:Robinson反應
- 領域:有機合成
反應機理,反應舉例,羅賓森增環反應,
反應機理
δ-烯醇內酯與格氏試劑作用,然後發生分子內羥醛縮合,得到五、六元環的雙環α,β-不飽和酮。反應以日裔美國化學家 George I. Fujimoto 和加拿大化學家 Bernard Belleau 的名字命名。整個過程產率很好。用於甾類化學。所形成的環己烯酮在甲醇中與碘反應可得苯甲醚衍生物。
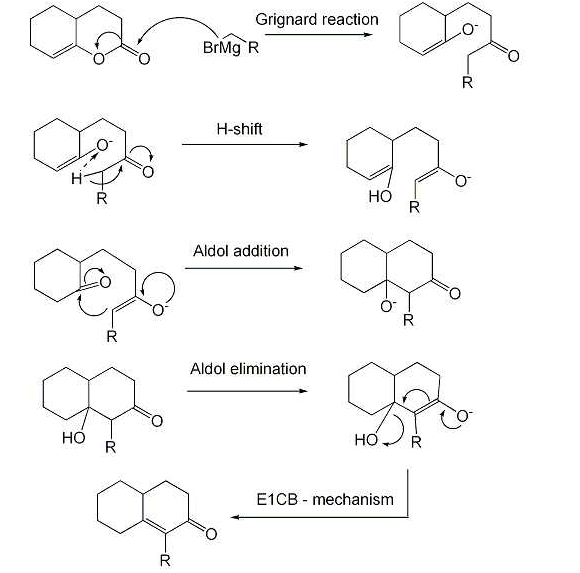 反應機理
反應機理反應中,先由鹼奪取底物離去基團的β-氫生成碳負離子(共軛鹼),然後該共軛鹼的離去基團離開,生成烯烴。E1cb反應是反式共平面的消除反應。
第一步反應為平衡反應,其速率較快,使底物很快與其共軛鹼形成平衡。
第二步為總反應的速率控制步驟,是較慢的一步。總反應的速率控制步驟只與一個分子有關,是單分子過程,因此稱為“E1”反應。但是與E1反應相比,此類反應中發生消除的不是底物分子,而是底物的共軛鹼,因此記為“E1cB反應”,全稱“單分子共軛鹼消除反應”。
具有以下特點的物質容易發生E1cB反應:
1)β-碳原子上連有強的吸電子基,從而使β氫具有較強的酸性,使碳負離子得以穩定。
2)離去基團難以離去。
反應舉例
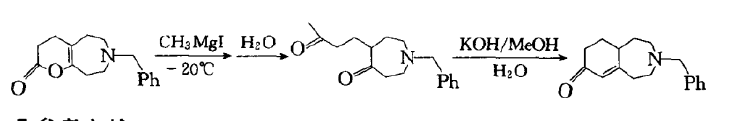 反應舉例
反應舉例羅賓森增環反應
羅賓森增環反應,該反應於1935年由英國R.羅賓森首先發現。是在鹼的催化作用下,環己酮及其衍生物與曼尼期鹼的季銨鹽作用,生成雙環α,β-不飽和酮的反應。
該反應最大的特點就是在一環上形成了一個新的六元環,形成二環結構。除此特點之外,該反應還可以在兩個環相稠合的碳原子上引入角甲基,角甲基是指兩個環共用碳上的甲基,這個甲基很難用其它方法引入,很多藥物如睪丸酮激素等有角甲基結構,可通過此法引入。羅賓森增環反應常用的鹼性試劑有氨基鈉、乙醇鈉和叔丁醇鉀等。由於甲基乙烯酮容易發生聚合反應,實際套用時常以其前身曼尼希鹼季銨鹽代替。後者在鹼性條件下容易分解而轉變為甲基乙烯酮:新生的甲基乙烯酮無需分離出來,立即可參加反應。