簡介
鹵代烴在無水乙醚或THF中和金屬鎂作用生成烷基鹵化鎂RMgX,這種有機鎂化合物被稱作格氏試劑(Grignard Reagent)。格氏試劑可以與醛、酮等化合物發生加成反應,經水解後生成醇,這類反應被稱作格氏反應(Grignard Reaction)。
格氏試劑是有機合成中套用最為廣泛的試劑之一,它是由法國化學家
格林尼亞(V.Grignard)發明的。
1871年,格林尼亞生於法國塞堡(Cherbourg Frace)。當他在
里昂(Lyons)大學學習時,曾師從巴比亞(P.A.Barbier)教授。當時,巴比亞主要從事有機鋅化合物的研究,他以鋅和
碘甲烷反應得到二甲基鋅,這種有機鋅化合物被用作
甲基化試劑。後來,巴比亞又以金屬鎂替代鋅來進行嘗試,也獲得相似的
金屬有機化合物,不過反應條件比較苛刻。於是。巴比亞便讓格林那繼續對有機鎂化合物的製備作深入研究。研究發現,用碘甲烷和金屬鎂在
乙醚介質中反應可以方便地得到新的化合物,不經分離而直接加入醛或酮就會發生進一步反應,反應產物經水解後可以得到相應的醇。
後來的研究表明,烷基
鹵化鎂(即格氏試劑)可以用於許多反應,套用範圍極廣,因而很快成為有機合成中最常用的試劑之一。
格氏試劑的發明極大地促進了有機合成的發展,格林尼亞因此而獲得1912年
諾貝爾化學獎。
通常,各種
鹵代烴和鎂反應都可以生成格氏試劑。不過,不同的鹵代烴與鎂反應活性有差異。一般來講,當烷基相同時,碘代烷最易反應,氟代烴活性最差RI > RBr > RCI >> RF
實際上還沒有人用氟代烴制格氏試劑。
當鹵素
原子不變時,苄基鹵代烴和
烯丙基鹵代烴活性最高,乙烯基鹵代烴活性最低:
ArCH2X、CH2=CHCH2X >3 o RX > 2 o RX >1 o RX > CH2=CHX
格氏試劑對水十分敏感,其次為CO2,最後為O2。事實上,凡是具有活潑氫的化合物都可以和格氏試劑反應,例如醇、末端
炔烴、伯胺及羧酸等。因此,在製備格氏試劑時,應該使用無水試劑和乾燥的儀器。
2 RMgX + O2 == 2 ROMgX
不過,在以乙醚作溶劑的格氏反應中,由於乙醚的
蒸氣壓較大,反應液被乙醚氣氛所包圍,因而空氣中的CO2和O2氣體對反應的影響不明顯。
通用方法
溶劑的準備
⑴ 無水乙醚的製備
檢測
過氧化物的方法:取5mL左右待處理的乙醚,加入等體積2%
碘化鉀溶液並滴入幾滴稀鹽酸,振搖後若使澱粉溶液呈紫色,即表明乙醚中含有過氧化物(也可用澱粉—碘化鉀試紙檢驗;或者用5mL乙醚加1mL 10%碘化鉀溶液,振搖1min後如有過氧化物則放出遊離碘,水層則呈黃色,再加4滴0.5%澱粉液後,水層呈藍色則表示乙醚中有過氧化物)。
檢測水分的方法:在1mL乙醚溶液里加入約0.1g硫酸銅粉末,振盪後若硫酸銅粉末變成藍色則表示有水存在,或者採用卡爾菲休法直接檢測含水量,或者加入約3-4片二苯甲酮試劑,乙醚顏色變為漂亮的藍色說明沒有水存在,檢其含水量應≤0.06%時就能符合發生格氏反應的要求了。
去除
過氧化物的方法:將
乙醚轉入分液漏斗,加入相當於乙醚體積1/5的新配的FeSO4溶液(硫酸亞鐵溶液的製備:取100 mL水,慢慢加入6 mL濃硫酸,再加入60 g硫酸亞鐵溶解),劇烈振搖,靜置分層,除去水相。然後,將除去過氧化物的乙醚分餾兩次(不論何時都不要將乙醚蒸乾),每次都收集33℃~37℃餾分。
去除水份的方法:先用無水氯化鈣乾燥(一般情況下,只要加入足量的CaCl2後放置3、4天,過濾後就可以直接使用了),再壓入鈉絲過夜,蓋上帶有毛細管的瓶蓋,以便讓產生的氫氣逸出。當壓入的鈉絲表面仍具有光澤或溶劑中不再冒泡,表明溶劑可以用於格氏反應。
乙醚須保存在棕色玻璃瓶中。除去過氧化物的乙醚久置後仍然會產生過氧化物,而且乙醚很容易吸收空氣中的水分。因此,處理後的乙醚應及早使用,不可久置。
⑵ 無水THF的準備
THF的水份越低越好,一般要在500ppm以下。工業生產中買回德國進口的THF一般不用乾燥的,因為水份都在200 ppm以下約100 ppm左右。或者買回工業級的THF用4A分子篩乾燥24~48h(使用之前,最好在300~400℃烘烤3小時活化後,在乾燥器里冷卻後直接放入要乾燥的溶劑里),加入二苯甲酮作為指示劑,液體顏色變藍時說明乾燥好了。
鎂屑處理
把
鎂帶表面的氧化膜用砂紙磨去,用剪刀把鎂帶剪碎成屑狀,再用10%的鹽酸加熱鎂屑至所有鎂屑表面為亮白色,並回流0.5h以徹底清洗去除表面的氧化膜。再用10%的鹽酸加入適量到鎂屑中攪拌,立即減壓抽濾,用丙酮沖洗鎂屑,65攝氏度下
真空乾燥3h左右,N2保護下保存備用。
製備
關鍵是無水無氧操作。
N2保護的250mL四口燒瓶上,配置乾燥潔淨的攪拌器、恆壓滴液漏斗和帶有CaCl2和無水NaHCO3乾燥管的回流冷凝管。向四口燒瓶中置入29.2g(1.2mo1)
鎂屑,用20mL?無水乙醚浸沒(所用儀器均需乾燥,溶劑和試劑都必須經過乾燥處理)。
攪拌下,先滴入約占總量10%的
鹵代烴乙醚溶液(由0.1mol鹵代烴和適量
無水乙醚配製而成)。如果反應液呈現混濁狀並且溫度上升,表明反應已經引發成功。如果沒有產生上述現象,則需要加入1~2小粒碘晶,並用電吹風微微加熱至回流(可用熱水浴加熱,切不可用明火加熱)碘的顏色開始漸漸消褪,溶液變混濁,反應即開始,迅速撤去加熱源。將餘下的鹵代烴乙醚溶液滴 應瓶中,滴速以維持反應液平穩沸騰為宜。此時要劇烈攪拌,這樣可沖刷掉在鎂表面形成的粘稠的格氏試劑,使鎂能和新鮮的鹵化物接觸良好順利反應。反應引發成功後滴加的速度不能太快,約1滴 / 2秒。此時應控制反應溫度,不能太高,用手背感覺其反應瓶壁的溫度稍稍有些燙手即可。
滴畢,再用小火加熱回流約半小時使反應完全,即得格氏試劑
乙醚溶液(空氣中的氧會與格氏試劑發生緩慢的氧化,格氏試劑的乙醚溶液在暗室里會發出美麗的光,就是這個緣故。因此格氏試劑不可久置,通常隨制隨用),其反應完成後顏色是發灰黑色的。若滴完以後燒瓶內仍有大量
鎂屑沒反應完,可再加熱回流1~2小時。
物質影響
底物的結構
底物結構對格氏反映的影響
格氏製備活性基本上是I > Br > Cl >> F,但因
碘化物的價格較貴,所以生產上能選用Cl、Br的原料製備就儘量選用Cl、Br原料,儘量不要用碘化物。
引發劑可以選擇Br取代的物料,這樣我們引發劑的用量可以適當的增加,使反應能更順利的進行,而不會影響引發劑的殘留在產品中產生雜質。
用
溴苯做格氏反應則非常容易,用THF回流,引發劑都不用加,還需要防止反應過快而沖料。
如果原料活性太強,則可控制反應溫度在0~20℃之間。
但是,氯苯用同樣的方法就實現不了。用氯代烴做底物時,因其活性較低,所以比較難引發,需回流了半個小時以上才能引發成功。一般做法是直接與
鎂粉回流數小時,同時還要加入硝酸鹽或硝基物催化,不加THF或Et2O。
當使用芳環上含有帶氟取代基的多鹵代芳烴來製備格氏試劑時,
芳基上的氟只要不在溴(或氯)的
鄰位,格氏試劑的製備是沒問題的,直接用鎂和原料在溶劑中製備即可,很容易引發。只要格氏試劑的濃度不是很高的話,基本就沒有什麼副產。而且,氟原子的存在會使格氏試劑的製備更容易,用THF或者
乙醚做溶劑都可以,即使在回流溫度下,氟原子也不會發生變化,收率也很高,3、4、5-三氟
溴苯的格氏試劑都沒問題。
有一本外文書專門介紹格氏試劑(?Organomagnesium methods in organic synthesis)的,其中有幾章,好像溫度偏低一點(-30℃)就能抑制芳香環上溴的格氏化反應。所以要想不發生氟上的反應,溫度不能高,只要溴原子的部位發生格氏反應能進行就可以了。溶劑中好像提到要添加N-甲基
嗎啉,更能選擇性格氏化反應。
用量和細度
鎂的用量和細度對格氏反應的影響
⑴ 鎂的用量對格氏反應的影響
關於鎂的量有很多種說法:有的說鎂應大大過量,與底物的
摩爾比達3.7:1,這樣可以防止生成的格氏試劑和原料發生
偶聯反應。但更多資料上說鎂的用量為與底物的
摩爾數相等或稍過量一些(與底物的摩爾比為1.1:1),反應完全則鎂全部溶解。
⑵ 鎂的細度對格氏反應的影響
可以根據原料的反應活性來確定鎂的細度。如果底物活性低,那么鎂應剪碎點來增大表面積,因為格氏反應是在鎂表面上進行的。
水分
水分對格氏反應的影響
水分(或是活潑
質子)的影響是關鍵,也就是對
原輔料的質量控制和設備的乾燥處理要求較高。在投料前沒有將這些準備措施做好將直接影響反應的進行,特別是反應的引發。即使本來是已經引發好了的,但是當滴加水分較高的原料後,由於水分(或是活潑質子)的影響也會將反應蓋滅了。如果是由於水分的影響使反應不能正常進行的,現象會由溶液正常的灰黑色變成白色(或乳白色)渾濁狀。此時需十分注意,應加入較多的引發劑來保證接續的操作不會被阻斷。
種類和用量
引發劑的種類和用量對格氏反應的影響
如果反應能自行引發,就不用加引發劑。
引發劑可以用碘甲烷、碘和1,2-
二溴乙烷,其中碘甲烷的效果要比碘好一點。當某些底物不容易引發時,可以考慮加入少量1,2-二溴乙烷,也可用以前做成功的格氏試劑來引發。
若選用
乙醚做溶劑,引發時,室溫下先加少量的
溴苯後啟動攪拌,如果溫度升高或有回流,則說明反應已經引發成功了,這時不用碘也可以。
引發劑不要加多,加多了
副產物會變多,小試的時候加一兩粒碘就可以了。
反應體系引發成功的現象是:取少量樣品出來,加碘立即退色就說明已經引發成功了,或滴加反應液時有氣泡、有放熱也能說明已引發成功。
如果反應引發不了,應從以下幾個方面查找原因:
⑴溶劑、原料的含水量是否≤0.06%;
⑵ 鎂是否已經有氧化現象;
鎂屑表面要發亮,說明沒有氧化膜,而且比表面積越大越好,也就是表面越毛越好。如果為了保險,也為了偷懶,有機化學網首頁有介紹利用
紅鋁用來引發格式反應,它能將鎂表面氧化膜去除,還能去除溶劑中沒處理好的水分,從而非常好的引發反應,但價格有點貴,可用來引發量小、不太涉及成本的格氏反應。
應從以下幾個方面解決問題:
⑴ 原料脫水;
⑵ 用新鮮的鎂;
⑶ 再補加少量1,2-
二溴乙烷後適當升溫至微微回流;
⑷ 用上次制好的格氏試劑或者小樣做一點格氏試劑也可以作為這次投料的
引發劑。補加適量上次成功引發的格氏液,回流半小時後加進去。
選擇和用量
溶劑的種類的選擇和用量的影響
⑴ 溶劑的種類的選擇對格氏反應的影響
一般會選擇絕對乙醚、無水THF和無水甲基THF這三種溶劑。
通常選用絕對乙醚作溶劑。這是由於乙醚分子中的氧原子具有孤對電子,它可以和格氏試劑形成可溶於溶劑的配合物。若使用其他溶劑,如烷烴,反應生成物則會因不溶於溶劑而覆蓋在金屬鎂表面上,從而使格氏反應終止。空氣中的O2和CO2氣體對反應的影響不明顯。
除了
乙醚外,THF也是進行格氏反應的良好溶劑。尤其是當某些
鹵代烴如氯乙烯、氯苯等,在乙醚中難以和鎂反應,此時如果以
四氫呋喃替代乙醚作溶劑,則可以順利地發生反應。由於四氫呋喃的沸點(66℃)比乙醚(34.6℃)高一些,因而以THF作溶劑進行格氏反應比用乙醚要安全一些。
芳香族
鹵化物一般選用THF做溶劑。因為它們在乙醚的沸點時候一般不能引發,需要升高反應溫度才行。而用烷基鹵化物做格氏反應時一般用乙醚做溶劑,因為它們在較低溫度下就可以引發。THF處理沒有乙醚方便,吸水厲害,價格也高。用
溴甲烷做格氏反應時,曾經有人在做2-甲基-2-金剛烷醇的時候做過,比較好做,低溫下5~10℃就可以了。
在絕大部分格氏反應中溶劑甲基THF和THF是通用的。由於甲基THF的沸點(80℃)比THF的沸點(66℃)高,這樣就可以提高
反應速度。另外格氏試劑在甲基THF中的溶解度也較大,而甲基THF在水中的溶解度比THF低,因此可以更容易地將
格利雅反應產物獨立地包含在其中。甲基THF的另一個重要優點是有更清晰的分相能力,通常使用THF置換甲苯時出現的乳濁液層或者
混合層在換用甲基THF後就可以避免此現象的發生。回收乾燥的甲基THF也比回收THF更容易,甲基THF價格還跟THF差不多,使得它比THF比有很多明顯的優點,可能做格式反應效果會更好。
我們應根據
鹵代物的活性來調整反應溫度、溶劑用量,或更換溶劑的種類。如果底物中有苄基就很活潑容易自偶連的話,則需要用大量乙醚稀釋來減少
副反應。
⑵ 溶劑的用量對格氏反應的影響
一般在引發時底物可被溶劑稀釋10~20倍左右。
反應溫度
反應溫度對格氏反應的影響
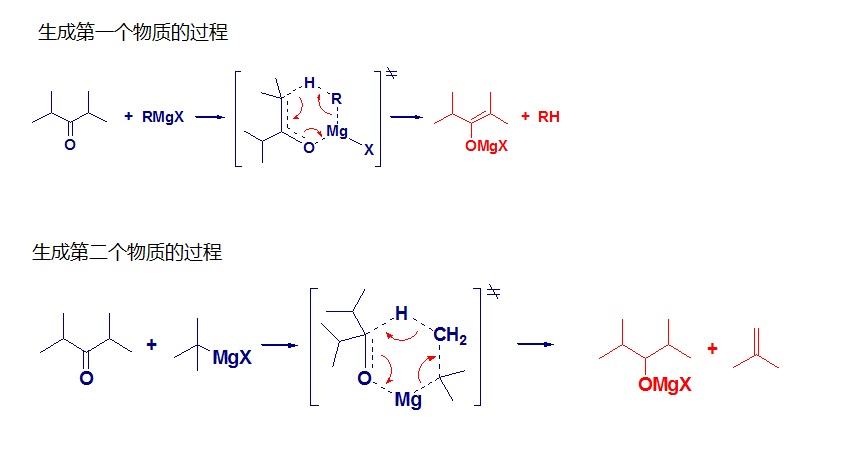
溫度對於引發非常重要。如果引發不成功,可稍稍加熱,但溫度不能過高,否則會發生偶聯反應。
反應溫度應保持在微微回流溫度。如果溫度較高,則易發生偶聯反應生成副產;溫度太低,則
反應時間變長且反應不徹底。
操作要求
實驗引發階段
引發時溶液不能過濃,否則易發生偶聯反應。
應仔細觀察實驗現象的變化,如反應溫度和體系顏色的改變等。如確定反應已引發成功,一般開始時是不加熱的,否則會因反應劇烈有沖料的危險。
如果由於操作失誤已經加入過多的物料,引發後放熱十分劇烈,則因時刻關注釜內的反應情況和溫度變化、回流流量的情況等,及時開冷卻水降溫,這樣可適當減少沖料的幾率。
有時,在不引起操作人員注意的時候,等滴加液累積到一定的量後,一旦引發再次進行,將急劇反應放出大量的熱,輕則沖料引起物料損失,重則發生爆炸事故。
滴加反應液
在大量滴加反應液前,必須十分肯定反應已經引發,並且能順利將加下去的反應液反應掉。否則既便不是很確定,就不能進行連續滴加操作,而且在不確定時累積滴加的量最多不能超過總量的10%。
滴加反應液的速度以保證反應體系有微微回流的現象為宜,一般控制在1滴 / 2秒左右。如果滴加速度過快,則回流現象明顯,溫度升高,此時容易發生
偶聯副反應。
為了減少格氏反應中的偶聯副反應,通過控制好滴加速度來控制反應溫度是關鍵。另外還應該把溶劑量控制在
底物的10倍左右,n底物:n鎂控制在1:1.1左右。
反應結束後
如果生成的格氏試劑馬上要接著做下步反應,而剩餘少量鎂,則可以用針筒把反應液轉移到另一反應瓶中去繼續反應。
格氏製備好後都要求過濾除去未反應的
鎂屑,這個鎂屑處理起來很麻煩,最好還是投回去做格氏反應,它的表面已經被活化了,更容易引發反應。
多餘不要的格氏試劑用飽和
氯化銨溶液
猝滅,要在冰水浴下慢慢滴加進去,一下子加進去反應會很劇烈。如果量少的話,一般用5%的鹽酸來猝滅就可以了。
工業生產
注意問題
投料時,原料的管道跟溶劑的管道應分開,否則會把在管道中的
死體積的原料量帶入反應鍋中,投料完了,一開攪拌就沖料了。
投料時一定注意鎂是否已加,數量是否準確,不然反應到鎂消耗完了就停止反應了,這時一定不能補加鎂,不然就沖料了。應該從上鍋口將鍋內的液體吸出到乾燥的鍋中,再加鎂,溶劑,將吸出的液體滴加進去。不能從下口放料是因為鍋底閥中會有一些鎂沒有被攪拌出來,放料時會被帶出立即跟原料反應,造成沖料。
選擇溶劑
現代的THF價格嚇人,加苯,甲苯替代一部分的THF,但會影響有些格氏試劑的溶解度,可加六甲基磷醯三胺
助溶。還可以在格氏反應完後先蒸出一部分溶劑後再水解,一定不能蒸乾。蒸出的溶劑最好是放在稀釋原料中使用,不要放入格氏鍋中,如蒸出的溶劑中有與格氏試劑反應的雜質,那就不能直接用了,需要處理。另這幾天看到甲基
THF,介紹不錯,沸點高,格氏試劑的溶解度大,在水中的溶解度小,水解後分層清楚,回收容易,價格跟THF差不多,如果真是的話,那是做格氏的福音了。
過程中的監控
格式反應過程中的監控
加顯示溫度計,觀察回流速度來調節滴加的速度,上面的問題都注意的話一般在這裡不太會出現什麼問題了。有的工廠滴加非常快,是邊冷卻邊滴加的,很牛,常人不敢這么做。我聽國外的工廠是溫度與滴加聯動裝置,溫度是波浪性型的,滴加是斷續的,滴加後等溫度升高后降了再滴加的,哪個步驟沒升溫或溫度高到某個設定值就報警了。
轉移格氏液
轉移格氏液時應注意的問題:
轉移格氏液可用虹吸法。一鍋內乾燥密閉抽真空後,關閉真空閥,將格氏鍋中的上層清液吸過來。這樣的好處是溶劑損失少,下鍋格氏反應也不用再引發了,直接加溶劑,鎂,滴加就可。下一步是滴加格氏液的話,可做上下層平台,上層的格氏鍋底閥上升入鍋底一節管,管上口封了鑽眼,反正滴加格氏液的速度不用太快的。
回收方法
一鍋中加二甘醇,NaOH,加熱減壓蒸水,至頂溫到90℃,算一下溶劑中的水分量與加的NaOH量確定加多少溶劑。回流幾小時,蒸出,水分基本在0.2%以下的,鍋內的二甘醇再蒸水循環使用。回收的溶劑中有與格氏反應的雜質的話,要把它處理掉。
處理